Первый закон термодинамики
Основные понятия и определения термодинамики
Термодинамика, наука о взаимопревращениях различных видов энергии. Различают общую (физическую), химическую и техническую термодинамику.
Техническая термодинамика, наука, изучающая закономерности взаимного превращения теплоты и работы в технических устройствах различного назначения.
Энергия, общая количественная мера различных форм движения материи. Размерность Дж или Дж/кг.
Работа, форма преобразования энергии в результате макроскопического перемещения тел. Количество преобразованной в этом случае энергии называют количеством работы или работой. Обозначается: полная работа L, Дж, удельная работа l, Дж/кг. Различают: работу изменения объема 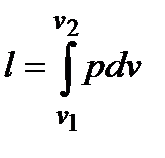 ; работу располагаемую
; работу располагаемую 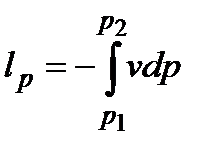 ; работу проталкивания
; работу проталкивания 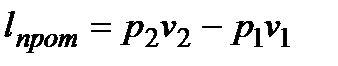 .
.
Теплота, форма преобразования энергии в результате микроскопического движения тел. Количество преобразованной в этом случае энергии называется количеством теплоты или теплотой. Обозначается: полная теплота Q, Дж, удельная теплота q, Дж/кг.
Рабочее тело, вещество, посредством которого происходит взаимопревращение теплоты и работы.
Термодинамическая система (система), совокупность тел, участвующих в процессах переноса (преобразования) энергии.
Окружающая среда, совокупность тел, не входящих в термодинамическую систему.
Открытая система, система, в которой имеет место обмен вещества с окружающей средой.
Закрытая система, система, в которой отсутствует обмен вещества с окружающей средой.
Адиабатная система, система, в которой отсутствует теплообмен с окружающей средой.
Изолированная система, система, которая не обменивается энергией и веществом с окружающей средой.
Термодинамические параметры состояния, физические величины, однозначно характеризующие состояние термодинамической системы. Различают термические и калорические параметры состояния. Термические параметры состояния: давление, удельный объем, температура. Калорические параметры состояния(функции состояния): внутренняя энергия, энтальпия, энтропия.
Экстенсивные термодинамические параметры, параметры, зависящие от массы вещества, например, внутренняя энергия, энтальпия, энтропия.
Интенсивные термодинамические параметры, параметры, не зависящие от массы вещества, например, давление, температура.
Удельный объем, объем единицы массы вещества, v = V/M, м3/кг.
Мольный объем, объем моля (киломоля) вещества, Vm = V/N, м3/кмоль.
Плотность, масса единицы объема вещества, r = M/V = 1/v, кг/м3.
Температура, мера интенсивности теплового движения микрочастиц вещества (атомов, молекул, ионов). Температуру, измеренную по шкале Цельсия, обозначают t, оС.
Термодинамическая (абсолютная) температура, температура, отсчитываемая по термодинамической шкале температур (шкале Кельвина) от абсолютного нуля. Обозначают ТК. Связь между температурами по шкале Цельсия и Кельвина: Т = t + 273.
Абсолютное давление (давление), отношение силы, действующей по нормали к поверхности тела, к площади этой поверхности. Обозначают р, Н/м2 (1 Н/м2 = 1 Па, 106 Па = 1 МПа, 103 Па = 1 кПа). Существуют другие единицы измерения давления, связь между некоторыми из них следующая: 1 ат = 1 кг/см2 = 0,981 бар = 98100 Па = 735,5 мм рт. ст. = 104 мм вод. ст. Разность между абсолютным давлением и барометрическим (атмосферным) называют избыточным давлением. Это давление не является параметром состояния.
Нормальные условия, условия, реализуемые при температуре t = 0 oC и давлении р = 101325 Па.
Уравнение состояния, уравнение, связывающее между собой термодинамические параметры системы в равновесном состоянии. Например, термическое уравнение состояния связывает давление, температуру и удельный объем: F(p, v, T) = 0.
Равновесное состояние, состояние системы, характеризующееся равенством термодинамических параметров во всех её частях.
Неравновесное состояние, состояние системы, характеризующееся неравенством термодинамических параметров во всех её частях.
Термодинамический процесс, последовательность изменяющихся состояний термодинамической системы.
Равновесный процесс, процесс, рассматриваемый как непрерывный ряд равновесных состояний системы.
Неравновесный процесс, процесс, рассматриваемый как непрерывный ряд неравновесных состояний системы. Любой реальный процесс является неравновесным. Если скорость осуществления неравновесного процесса бесконечно мала, его можно рассматривать как равновесный процесс.
Обратимый процесс, процесс, в результате совершения которого в прямом и обратном направлениях, система возвращается в начальное состояние без изменений в окружающей среде. Равновесные процессы обратимы.
Необратимый процесс, процесс, в результате совершения которого в прямом и обратном направлениях, система не возвращается в начальное состояние без дополнительной затраты энергии. Неравновесные процессы необратимы.
Термодинамическая диаграмма, диаграмма, в которой по осям координат откладывают значения термодинамических параметров или функций состояния (pv-диаграмма, Ts-диаграмма и т. д.). В диаграммах можно изображать равновесные термодинамические процессы. Например, 1-2 – процесс расширения (dv > 0). Так как работа изменения объема газа 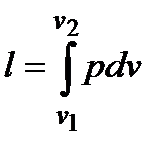 , то площадь под процессом равна работе l. Аналогично, площадь слева от процесса равна располагаемой работе
, то площадь под процессом равна работе l. Аналогично, площадь слева от процесса равна располагаемой работе 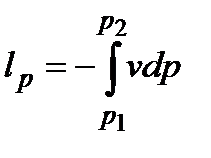 .
.
| p |
| v |
| l |
Уравнение состояния идеального газа, уравнение Клапейрона pV = MRT или уравнение Менделеева-Клапейрона 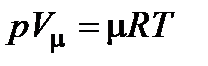 . Здесь Vm = 22,4 м3/кмоль – объем киломоля идеального газа.
. Здесь Vm = 22,4 м3/кмоль – объем киломоля идеального газа.
Универсальная газовая постоянная, постоянная для всех идеальных газов (mR), входящая в уравнение Менделеева-Клапейрона. Численно равна mR = 8314,34 Дж/(кмоль×К).
Газовая постоянная, характерная для каждого идеального газа постоянная (R), входящая в уравнение Клапейрона. Численно равна работе изменения объема 1 кг газа в изобарном процессе при изменении температуры на 1К. Может быть определена из выражения R = 8314/m Дж/(кг×К), где m – молекулярная масса газа.
Смесь идеальных газов, механическая смесь химически не взаимодействующих газов. Каждый компонент смеси является идеальным газом.
Закон Дальтона, закон, определяющий поведение смеси идеальных газов. Утверждает: каждый компонент ведет себя в газовой смеси так, как будто он один при температуре смеси занимает весь объем смеси.
Парциальный объем, объем, который имел бы газ, входящий в газовую смесь, если бы он находился при давлении и температуре смеси. Сумма парциальных объемов компонентов смеси равна объему смеси.
Парциальное давление, давление, который имел бы газ, входящий в газовую смесь, если бы он имел объем смеси при температуре смеси. Сумма парциальных давлений компонентов смеси равна давлению смеси.
Концентрация, величина, характеризующая относительное содержание компонента в смеси.
Объемная доля (концентрация), отношение парциального объема компонента (Vi) к объему смеси (Vсм): ri = Vi/ Vсм.
Массовая доля (концентрация), отношение массы компонента (Мi) к массе смеси (Мсм): gi = Mi/Mсм.
Мольная доля (концентрация), отношение количества молей компонента (Ni) к общему количеству молей смеси (Nсм): xi = Ni/Nсм.
Кажущаяся молекулярная масса смеси, условная величина, позволяющая проводить расчеты со смесью идеальных газов как с однокомпонентным рабочим телом. В зависимости от способа задания состава смеси рассчитывают по формулам: 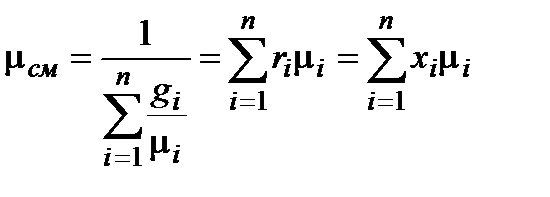 , где п – количество компонентов в смеси.
, где п – количество компонентов в смеси.
Газовая постоянная смеси, условная для смеси идеальных газов постоянная (Rсм), входящая в уравнение Клапейрона. Определяют из выражения: 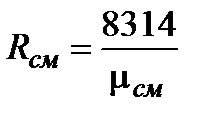 , Дж/(кг×К).
, Дж/(кг×К).
Теплоемкость, количество теплоты, необходимое для изменения температуры тела на 1 К. Обозначается С, Дж/К.
Удельная теплоемкость, теплоемкость единицы количества вещества. Теплоемкость единицы массы вещества (1 кг) называют массовой удельной теплоемкостью или просто массовой теплоемкостью: с, Дж/(кг×К). Теплоемкость единицы объема при нормальных условиях называют объемной теплоемкостью: с', Дж/(м3н×К). Теплоемкость 1 кмоля вещества называют мольной (или молярной) теплоемкостью: mс, Дж/(кмоль×К). Связь между удельными теплоемкостями: с = mс/m, с' = mс/22,4 = rн×с,mс = с'×22,4.
Средняя теплоемкость, теплоемкость (ст), отнесенная к интервалу температур DТ = Т2 – Т1. Определяют из выражения: ст = q/(T2 – T1).
Истинная теплоемкость, теплоемкость, соответствующая бесконечно малому изменению температуры dT: с = dq/dT.
Изобарная теплоемкость, теплоемкость в изобарном (p = const) термодинамическом процессе. Обозначают ср, ср', mср.
Изохорная теплоемкость, теплоемкость в изохорном (v = const) термодинамическом процессе. Обозначают сv, сv', mсv.
Уравнение Майера, уравнение, устанавливающее связь между изобарной и изохорной теплоемкостью идеального газа: ср – сv = R или mср – mсv = mR = 8314.
Теплоемкость смеси идеальных газов, теплоемкость, определяемая суммой произведения концентрации компонентов на соответствующую теплоемкость компонента. В зависимости от способа задания состава смеси теплоемкость смеси определяют по формулам: 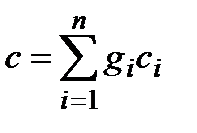 ,
, 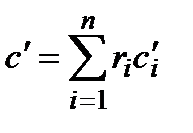 ,
, 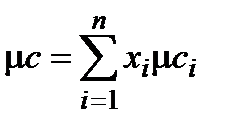 , где п – количество компонентов в смеси.
, где п – количество компонентов в смеси.
Первый закон термодинамики
Первый закон термодинамики, утверждает, что энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических и химических процессах. Применительно к задачам технической термодинамики, аналитическое выражение первого закона может быть представлено в виде:
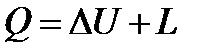 ,
, 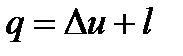 ,
, 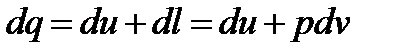 ,
,
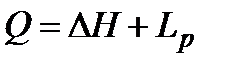 ,
, 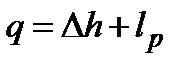 ,
, 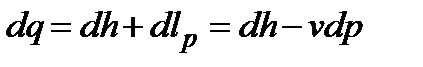 .
.
Внутренняя энергия, функция состояния системы, характеризующаяся тем, что её величина включает все виды кинетической и потенциальной энергии микрочастиц вещества. Обозначают: полная внутренняя энергия U, Дж, удельная внутренняя энергия u = U/M, Дж/кг. Изменение внутренней энергии в процессе не зависит от пути его протекания, а определяется только начальным и конечным состояниями. Для идеального газа изменение внутренней энергии зависит только от температуры и определяется из выражения: 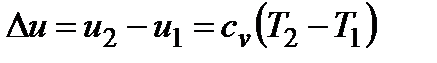 .
.
Энтальпия, функция состояния системы, определяемая суммой внутренней энергии и произведения объема на давление в системе. Обозначают: полная энтальпия 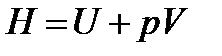 , Дж, удельная энтальпия
, Дж, удельная энтальпия 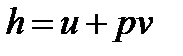 , Дж/кг. Изменение энтальпии в процессе не зависит от пути его протекания, а определяется только начальным и конечным состояниями. Для идеального газа изменение энтальпии зависит только от температуры и определяется из выражения:
, Дж/кг. Изменение энтальпии в процессе не зависит от пути его протекания, а определяется только начальным и конечным состояниями. Для идеального газа изменение энтальпии зависит только от температуры и определяется из выражения: 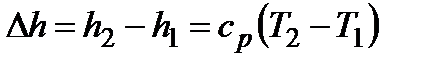 .
.
Энтропия, функция состояния системы, дифференциал которой в равновесном процессе равен отношению бесконечно малого количества теплоты (dQ или dq), сообщенной системе, к термодинамической температуре (Т) системы. Обозначают: полная энтропия 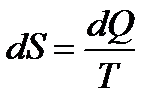 , Дж/К, удельная энтропия
, Дж/К, удельная энтропия 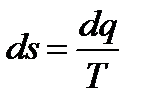 , Дж/кг. Поскольку Т > 0, то подвод теплоты в процессе (dq > 0) сопровождается увеличением энтропии (ds > 0), а отвод теплоты (dq < 0) сопровождается её уменьшением (ds < 0).
, Дж/кг. Поскольку Т > 0, то подвод теплоты в процессе (dq > 0) сопровождается увеличением энтропии (ds > 0), а отвод теплоты (dq < 0) сопровождается её уменьшением (ds < 0).
| s |
| Т |
| q |
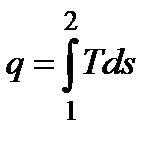 , то площадь под процессом в Тs-диаграмме равна теплоте q.
, то площадь под процессом в Тs-диаграмме равна теплоте q.
Дата добавления: 2018-11-25; просмотров: 691;
