Химические свойства аминокислот
3.2.3.1. Кислотно-основные свойства
Аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления, которые мало отличаются для разных аминокислот. Плавление сопровождается разложением вещества. Плавление с разложением характерно для солей.
Будучи солями, аминокислоты хорошо растворимы в воде. Водный раствор аминокислот имеет нейтральную реакцию, что также характерно для солей.
Аминокислоты представляют собой так называемые внутренние соли (биполярные ионы):
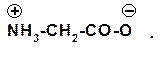
Такой ион в кислой среде ведет себя как катион, так как подавляется диссоциация карбоксильной группы, а в щелочной среде аминокислота ведет себя как анион:
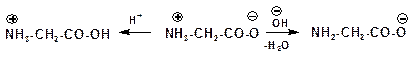
Значение рH, при котором достигается максимальная концентрация биполярного иона, называется изоэлектрической точкой.
Подобно другим соединениям со смешанными функциями, аминокислоты проявляют свойства кислот и аминов.
3.2.3.2. Образование солей
Аминокислоты образуют соли с основаниями. Соли α-аминокислот с тяжелыми металлами могут иметь координационный характер:
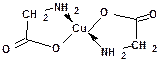
Медная соль аминокислоты имеет интенсивно синее окрашивание.
Аминокислоты образуют соли с неорганическими кислотами:
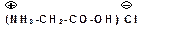
3.2.3.3 Свойства карбоновых кислот
Подобно другим карбоновым кислотам, аминокислоты образуют сложные эфиры, хлорангидриды, амиды и т. д.:
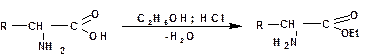
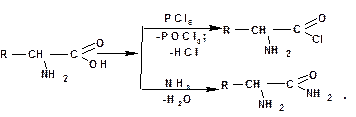
3.2.3.4. Свойства аминов
Под воздействием азотистой кислоты аминокислоты образуют гидроксикислоты:
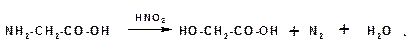
Аминогруппа в аминокислотах легко ацилируется при действии ангидридов и хлорангидридов кислот:
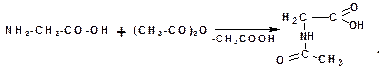
При алкилировании аминогруппы получаются вторичные и третичные аминокислоты. В избытке галоидного алкила образуются четырехзамещенные аммонийные основания. Внутренние соли таких оснований называются бетаинами:
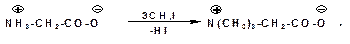
3.2.3.5. Поведение α-аминокислот при нагревании
α-Аминокислоты межмолекулярно образуют циклические амиды – дикетопиперазины:
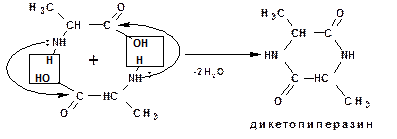
3.2.3.6. Поведение β-аминокислот при нагревании
β-Аминокислоты при нагревании отщепляют молекулу аммиака с образованием α,β-ненасыщенных кислот:
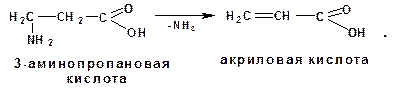
3.2.3.7. Поведение γ-аминокислот при нагревании
γ- и δ-Аминокислоты при нагревании отщепляют воду и образуют внутримолекулярные циклические амиды – лактамы:
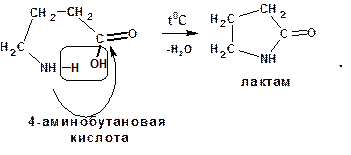
Белки
Классификация
Определение. Сложные высокомолекулярные органические соединения, построенные из остатков аминокислот, соединенных между собой амидными связями, называются белками.
Белки разделяются на протеины (простые белки), в состав которых входят только остатки аминокислот, и протеиды (сложные белки). Это белки, построенные не только из аминокислот, но и из других веществ: сахаридов или остатков фосфорной кислоты, и нуклеиновые кислоты.
Белки классифицируются по трем группам.
1. Для протеинов классификация строится по растворимости в воде:
- альбумины – растворимые в воде и разбавленных растворах солей;
- глобулины– малорастворимые в воде и растворимые в разбавленных растворах солей;
- проламины – нерастворимые в воде и растворимые в водном спирте;
- глютелины – нерастворимые в воде, в разбавленных растворах солей и водном спирте, растворимы в растворах кислот и щелочей;
- склеропротеины – нерастворимые в воде, в разбавленных растворах солей, водном спирте и в растворах кислот и щелочей;
2. Для протеидов действует классификация по продуктам гидролиза:
- нуклеопротеиды – гидролизуются на протеины и нуклеиновые кислоты;
- фосфопротеиды– гидролизуются на протеины и фосфорную кислоту;
- глюкопротеиды – гидролизуются на протеины и углевод;
- хромопротеиды – гидролизуются на протеины и красящие вещества.
3. Все белки классифицируются по функциям в организме:
- резервные белки;
- структурныебелки;
- белки, управляющие метаболизмом.
Как и аминокислоты, белки обладают амфотерным характером и изоэлектрической точкой. Положение изоэлектрической точки для белков может колебаться в широких пределах от кислой до сильнощелочной.
Все белки оптически активны. Большинство из них обладает левым вращением.
Существует ряд качественных цветных реакций на белки.
Ксантопротеиновая, которая заключается в обработке белков концентрированной азотной кислотой, что приводит к появлению у них желтого окрашивания.
Биуретовая, в ходе которой происходит взаимодействие белков с солями меди в присутствии щелочи, что приводит к появлению фиолетовой окраски за счет образования комплексной соли.
Реакция Милона – это обработка белков раствором нитрата ртути в азотистой кислоте, при этом белки дают красное окрашивание.
Сульфгидрильная, которая заключается в нагревании белков с раствором плюмбита натрия, что сопровождается выделением черного осадка сульфида свинца.
3.3.2. Строение пептидов
3.3.2.1. Понятие пептидной связи
Белки построены из остатков 26 аминокислот. Аминокислоты делятся на заменимые, которые могут быть синтезированы организмом, и незаменимые, которые человеческим организмом не синтезируются (например, изолейцин и треонин).
Остатки аминокислот связаны в белковой молекуле амидными связями. Амидная связь в белках называется пептидной связью:
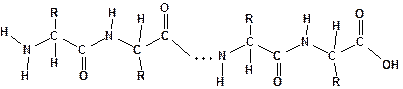
Карбоксильная группа одной молекулы аминокислоты образует амид, взаимодействуя с аминогруппой соседней молекулы аминокислоты. Отдельные пептидные звенья
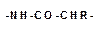
отличаются друг от друга только радикалами R при α-угле-родном атоме.
Соединения, содержащие несколько аминокислотных остатков, называются пептидами. Соединения с большим количеством пептидных звеньев называются полипептидами.
При исследовании полипептидов в первую очередь выясняют, из каких аминокислот построена макромолекула, а также то, какая аминокислота является N-концевой (свободная аминогруппа), а какая – С-концевой (свободная корбоксильная группа).
Белки полностью гидролизуются в аминокислоты концентрированной соляной кислотой или 2 % соляной кислотой при нагревании и при повышенном давлении. Гидролиз белков можно провести под воздействием щелочи. Выбор реагента зависит от того, какие конкретно аминокислоты необходимо получить из молекулы белка.
3.3.2.2. Определение N-концевой аминокислоты
Определение N-концевой аминокислоты проводят с использованием 2,4-динитрофторбензола. При взаимодействии 2,4-динитрофторбензола с пептидом фтор нуклеофильно замещается на концевую аминогруппу. Затем пептид подвергают гидролизу. Продукт взаимодействия концевой аминокислоты с 2,4-динитрофторбензолом выделяют, и кислоту идентифицируют:
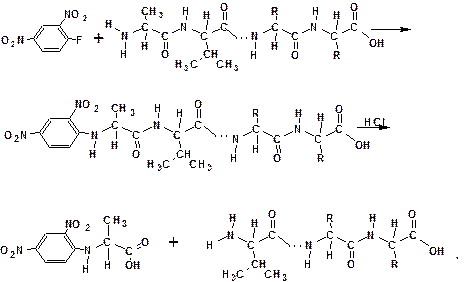
В тех случаях, когда 2,4-динитрофторбензол неприменим, используют фенилизотиоцианат.
3.3.2.3. Определение С-концевой аминокислоты
Для определения С-концевой аминокислоты (со свободным гидроксилом) пептид нагревают с гидразином при 1000С несколько часов. При этом все аминокислоты, кроме концевой, образуют гидразиды
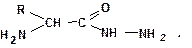
Аминокислоту, не образовавшую гидразид, выделяют и идентифицируют.
Более простой метод заключается в применении фермента карбоксипептидазы, который расщепляет пептидную связь только С-концевой аминокислоты. Ее можно выделить и идентифицировать.
3.3.3. Построение полипептидной цепи
Построение полипептидной цепи проводят по методу Э.Фишера. Метод основан на применении хлорангидридов α-галогензамещенных кислот. Например, надо получить цепи:
- глицилаланин (Gly-Ala):
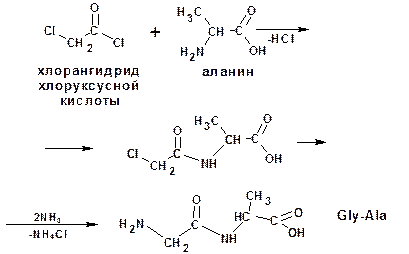
- аланилглицилвалин (Ala-Gly-Val):
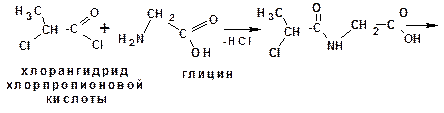
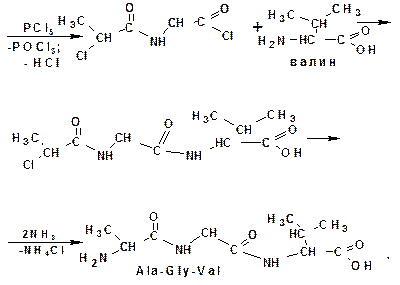
3.3.4. Структура белков
Последовательность аминокислот, ковалентно связанных между собой в полипептиде, составляет так называемую первичную структуру белка.
Собственно полипептид белком еще не является. Пептиды неспособны к функционированию. Выполнять какие-либо функции в организме способны более сложные системы, построенные из нескольких полипептидных цепей, определенным образом связанных друг с другом. Надмолекулярные структуры, сформированные полипептидными цепями, характеризуются вторичной, третичной и четвертичной структурой белка.
Вторичная структураобусловлена водородными связями между пептидно не связанными кислородом карбонильной группы и водородом аминогруппы.
Если карбонил и аминная группа принадлежат разным полипептидным цепям, то такая вторичная структура называется β-структурой. Если карбонил и аминная группа принадлежат одной и той же полипептидной цепи, то такая вторичная структура называется α-структура. Следствием α-структуры является существование полипептидной цепи в форме спирали навитой на циллиндр. Длина одного остатка 1,5 А0, длина шага спирали 5,4 А0. Водородные связи α-спирали образуются между каждой первой и четвертой аминокислотой.
Третичная структура белка формируется в результате складывания или свивания нескольких α-спиралей. При этом спирали удерживаются друг около друга за счет образования водородных связей, образованных боковыми амино-, гидрокси- и карбоксильными группами, а также дисульфидными связями и электростатически.
Четвертичная структура формируется как агрегат нескольких полипептидных цепей, имеющих вторичную и третичную структуры. Полипептидные цепи удерживаются в четвертичной структуре теми же силами, что и в третичной структуре.
Разрушение первичной, вторичной, третичной и четвертичной структуры белка называется денатурацией. Денатурация может быть вызвана термически (нагревание), химически, механически и т. д. При этом денатурация бывает обратимой и необратимой.
Необратимой является денатурация, связанная с разрушением первичной и вторичной структуры. После их разрушения белок самопроизвольно не восстанавливается (например, гидролиз белков или варка яиц, или мяса, взбивание яичного белка).
Денатурация третичной и четвертичной структуры является обратимой. После их разрушения белки могут самопроизвольно восстанавливаться с возвращением биологических функций (например, накручивание волос на бигуди (термическая денатурация) или химическая завивка).
Углеводы
Общие положения
Определение. Органические соединения, имеющие общую молекулярную формулу Сn(Н2О)n называются углеводами, или карбогидратами.
Углеводы являются представителями класса органических соединений, наиболее распространенных в природе в живых организмах. Углеводы составляют основу (80 % сухой массы) древесины и стеблей растений. Наиболее распространенными из них в растительном мире являются целлюлоза, крахмал, пектины, сахароза и глюкоза. Ряд углеводов выделяют из растительных источников в промышленных масштабах. Например, производство сахарозы достигает сотен миллионов тонн.
В живых организмах углеводы в первую очередь являются источником энергии для деятельности живой клетки, а также исходным сырьем для синтеза веществ в клетках.
Все углеводы делятся на две большие группы.
1. Моносахариды (монозы):
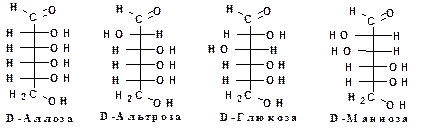
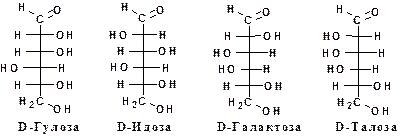
Монозы могут существовать в цепной форме:
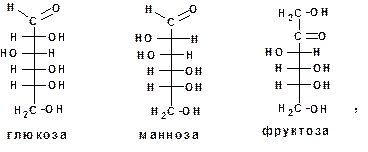
и в кольчатой форме:
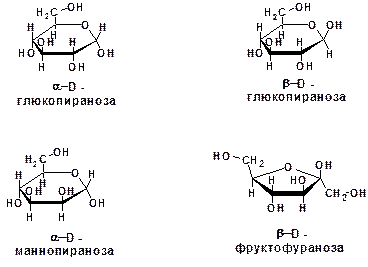
2. Полисахариды (полиозы), которые делятся на сахароподобные (так называемые олигосахариды) и несахароподобные.
К олигосахаридам относятся сахара, построенные из двух, трех и т. д. остатков моноз. Их соответственно называют дисахариды (биозы), трисахариды и т. д. Олигосахариды могут быть расщеплены на монозы:
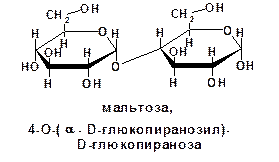
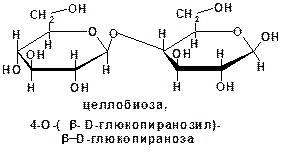
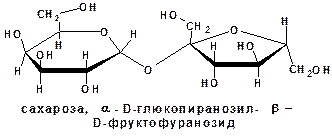
Несахароподобные углеводы могут быть расщеплены гидролизом на олигосахариды и монозы:
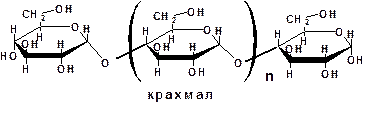
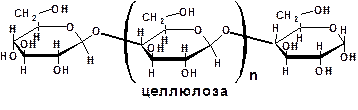
4.2. Моносахариды
Дата добавления: 2018-09-24; просмотров: 1660;
