Термохимические расчеты
Поскольку величины внутренней энергии, а следовательно, и энтальпии системы зависят от термодинамических параметров (температура, давление, количество вещества), то для термохимических расчетов необходимо привести тепловые эффекты реакций к одинаковым условиям. Чаще всего используют так называемые стандартные условия:
давление p0 = 1,013×105 Па, температура Т0 = 298,15 К.
Этим условиям соответствуют стандартные тепловые эффекты химических реакций, которые обозначают DrН0298.
Иногда в целях упрощения записи, когда ясно, что речь идет о стандартных условиях, нижний индекс, указывающий температуру, опускают. Если температура отлична от стандартной, то нижний индекс показывает, к какой температуре относится тепловой эффект DrН0Т.
Наиболее удобными для экспериментального определения тепловых эффектов являются реакции образования сложных веществ из простых и реакции сгорания сложных веществ в кислороде. Значения стандартных тепловых эффектов этих реакций приведены в справочной литературе.
Энтальпия образования веществ. Условились, что стандартная энтальпия образования простых веществ, находящихся в устойчивом состоянии (наиболее устойчивая модификация), принимается равной нулю.
Пример.
Водород при стандартных условиях газ, энтальпия образования газообразного водорода – DfН0298= 0 кДж/моль.
Ртуть при стандартных условиях жидкость, энтальпия образования жидкой ртути – DfН0298= 0 кДж/моль.
Углерод при 298 К может существовать в нескольких модификациях, например в виде графита и алмаза. Так как графит устойчивее алмаза, то (DfН0298)графит = 0 кДж/моль, а (DfН0298)алмаз = 1,83 кДж/моль.
Тогда стандартнаяэнтальпия образования сложных веществ (теплота образования) является количеством теплоты, которое поглощается или выделяется при образовании в стандартных условиях одного моля сложного вещества из простых веществ, взятых в наиболее устойчивой модификации:
1/2 А2 + 1/2 В2 = АВ + DfН0298.
Стандартная энтальпия образования веществ обозначается DfН0298 [кДж/моль]; индекс f происходит от англ. formation – образование. Известные значения стандартных энтальпий образования веществ приведены в справочной литературе, в разделе термодинамические характеристики веществ.
Теплота сгорания – количество теплоты, которое выделяется при полном сгорании одного моля вещества при стандартных условиях. Полным сгоранием является реакция взаимодействия исходного вещества и кислорода с образованием продуктов окисления атомов, входящих в молекулу вещества. Принято считать, что продуктами окисления углерода, водорода, азота, галогенов (Hal), металлов (Ме) будут являться соответственно CO2, H2O (жидкость), N2, HHal, MexOy.
Пример. Реакция полного сгорания вещества CcHhNnOoFf имеет вид
CcHhNnOoFf + x O2 = c CO2 + ( 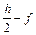 ) H2O +
) H2O +  N2 + f HF.
N2 + f HF.
Стандартная энтальпия сгорания веществ обозначается DсН0298, [кДж/моль]; индекс с происходит от английского combustion – сгорание.
Следствия из закона Гесса. Теплоты образования и сгорания веществ широко используют при определении тепловых эффектов химических реакций. Расчеты проводят на основании следствий из закона Гесса.
Первое следствие: тепловой эффект реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ с учетом числа молей реагирующих веществ:
DrН0298=(åniDfН0i)продукты–(åniDfН0i)исх. вещества.
Для реакции nаA + nbB = nсC + ndD тепловой эффект рассчитывается по уравнению
DrН0298=(nc×DfН0C + nd×DfН0D )–(na×DfН0A + nb×DfН0B ).
Второе следствие: тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учетом числа молей реагирующих веществ:
DrН0298=(å ni×DcН0i) исх. вещества –(å ni×DcН0i ) продукты.
Для реакции nаA + nbB = nсC + ndDтепловой эффект рассчитывается по уравнению
DrН0298=(na×DсН0A + nb×DсН0B)–(nc×DсН0C + nd×DсН0D).
Пример 1. Определение стандартного теплового эффекта реакции, если известны теплоты образования веществ.
А) Реакция образования сульфата алюминия из оксида алюминия и триоксида серы: Al2O3 (кр) + 3SO3 (газ) = Al2(SO4)3 (кр).
| Вещество | Al2O3 (кр) | SO3 (газ) | Al2(SO4)3 (кр) |
| DfН0298, кДж/моль | –1676,1 | –395,9 | –3442,8 |
Решение. Тепловой эффект реакции определяем по первому следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298=(1×DfН0Al2(SO4)3)–(1×DfН0Al2O3 + 3×DfН0SO3 ) =
=1×(–3442,8) – [1×(–1676,1) + 3×(–395,9)] = –579 [кДж].
Б) Реакция взаимодействия метана и диоксида углерода с образованием оксида углерода и водорода: CH4 (газ) + CO2 (газ) = 2 CO (газ) + 2H2 (газ).
| Вещество | CH4 (газ) | CO2 (газ) | CO (газ) | H2 (газ) |
| DfН0298, кДж/моль | –74,85 | –393,51 | –110,5 |
Решение. Тепловой эффект реакции определяем по первому следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298=(2×DfН0CO + 2×DfН0H2)–(1×DfН0CH4 + 1×DfН0CO2) =
=[2×(–110,5) + 2×0] – [1×(–74,85) + 1×(–393,51)] = 247,36 [кДж].
Пример 2. Определение стандартного теплового эффекта реакции, если известны стандартные теплоты сгорания веществ.
Реакция взаимодействия уксусной кислоты и этилового спирта с образованием сложного эфира – этилацетата:
CH3COOH(ж)+C2H5OH(ж)=CH3COOC2H5(ж) + H2О(ж)
| Вещество | CH3COOH(ж) | C2H5OH(ж) | CH3COOC2H5(ж) | H2О(ж) |
| DcН0298, кДж/моль | –873,79 | –1366,91 | –2254,21 |
Решение. Тепловой эффект реакции определяем по второму следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298 =(1×DcН0ук + 1×DcН0эс)–(1×DcН0эа + 1×DcН0H2O) = [1×(–873,79) +1×(–1366,91)] – [1×(–2254,21)+ 1×0] = 13,51[кДж].
Дата добавления: 2017-02-20; просмотров: 851;
