Химическая связь в жидкостях
Жидкое состояние вещества по степени упорядоченности взаимного расположения частиц и характеру их теплового движения занимает промежуточное положение между газообразным и кристаллическим.
Строение вещества и характер взаимодействия между частицами в жидкости имеет много общего с кристаллическим состоянием. Это сходство обусловлено близким взаимным расположением частиц (конденсированное состояние вещества) и сохранением характера химической связи между ними при фазовом переходе. Как правило, при плавлении молекулярных кристаллов получают молекулярные жидкости (частицами, образующими жидкость, являются молекулы), при плавлении ионных кристаллов – жидкости, состоящие только из ионов (электролиты), при плавлении металлических кристаллов – жидкие металлы. При плавлении ковалентных кристаллов в силу специфики характера ковалентной связи (насыщенность и направленность) поведение частиц в жидкости будет в сильной степени зависеть от химического состава вещества, при этом могут образовываться молекулярные и ионные жидкости (происходит полная или частичная диссоциация молекул на ионы) или жидкие металлы.
Частицы в жидкости, как и в твердом теле, совершают тепловые колебания около положений равновесия (период тепловых колебаний t0 ~ 10-12 c). Расположение частиц в пространстве в жидкости аналогично расположению частиц в стеклообразном состоянии («стекло – переохлажденная жидкость»).
Однако если в твердых телах эти положения равновесия фиксированы в пространстве и практически не изменяются во времени, то в жидком состоянии частицы по истечении некоторого времени t перескакивают в новое положение равновесия, перемещаясь на расстояние порядка среднего расстояния между ними. Эти перемещения и обусловливают текучесть жидкости, в силу которой жидкости изменяют свою геометрическую форму в поле силы тяжести, принимая форму сосуда или растекаясь по поверхности. Частицы поверхностного слоя обладают избыточной энергией по сравнению с объемными частицами, поскольку часть химических связей у этих частиц не реализуется (отсутствует часть ближайших соседей). Минимум энергии системы в отсутствие силы тяжести будет соответствовать форме, при которой доля поверхностных частиц будет минимальной, поэтому жидкое вещество самопроизвольно примет сферическую форму.
Для перехода из одного состояния равновесия в соседнее частицам необходимо преодолеть энергетический барьер Еа, величина которого зависит от характера химической связи между частицами. Процесс подобен образованию собственных дефектов в кристалле.
Среднее время между переходами t называется временем «оседлой жизни» частиц. Оно зависит от природы жидкости, то есть характера химической связи между частицами, и быстро уменьшается с ростом температуры: 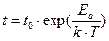 ,
,
где t0 ~ 10-12 c, k – константа Больцмана, Т – температура, К.
Для маловязких жидкостей время «оседлой жизни» частиц при комнатной температуре составляет величину ~ 10-11 с. Поэтому поведение примесных частиц в жидкости, если их концентрация невелика (сильноразбавленные растворы), подчиняется законам идеального газа.
Вещества, обладающие одновременно свойством текучести, как жидкость, и анизотропией некоторых физико-химических свойств, как кристалл вследствиеупорядоченности расположения молекул называются жидкими кристаллами.
Таким свойством могут обладать вещества, состоящие из молекул, имеющих определенную удлиненную палочкообразнуюили дискообразную форму. Палочкообразную форму чаще всего имеют органические молекулы, представляющие собою цепочки с чередованием линейных и циклических атомных группировок. Такая форма позволяет образовывать упорядоченные структуры с приблизительно параллельным расположением молекул, что является основным признаком жидких кристаллов.
Пример. В жидкокристаллическом состоянии могут находиться вещества, молекулы которых состоят из одного или нескольких бензольных колец с заместителями в пара-положениях (рис. 4.18).

Рис. 4‑18 Структурная формула молекул веществ, которые могут находиться в жидкокристаллическом состоянии
По степени упорядоченности структуры можно выделить три типа жидких кристаллов. Наименее упорядоченную структуру имеют нематические жидкие кристаллы, молекулы которых параллельны, но сдвинуты относительно друг друга на произвольные расстояния. В смектических жидких кристаллах молекулы располагаются слоями. Холестерические жидкие кристаллы по своей структуре похожи на нематические, но в отличие от них молекулы дополнительно закручены в направлении, перпендикулярном их длинным осям (рис. 4.19).

Рис. 4‑19 Взаимное расположение молекул в нематических и смектических жидких кристаллах
Структура жидких кристаллов легко изменяется при нагревании, под воздействием электрического и магнитного поля, механических напряжений. При этом резко меняются физические свойства жидких кристаллов, особенно оптические свойства, в частности рассеяние света.
Контрольные вопросы.
1. Межмолекулярные взаимодействия.
2. Водородная связь.
3. Кристаллическое состояние вещества. Типы кристаллов.
4. Ковалентные кристаллы.
5. Ионные кристаллы. Ионная сязь.
6. Химическая связь в металлах.
7. Зонная модель кристаллического тела: металлы, полупроводники и диэлектрики.
8. Кристаллические материалы. Дефекты кристаллической решетки.
9. Химическая связь в аморфных твердых телах и жидкостях.
ХИМИЧЕСКИЙ ПРОЦЕСС
Дата добавления: 2017-02-20; просмотров: 1141;
