ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ВЕЩЕСТВАХ И ЖИДКОСТЯХ
Вещества в зависимости от внешних условий (температура и давление) и их химического состава могут существовать в трех основных агрегатных состояниях: газообразном, жидком и твердом. При достаточно низких температурах вещества находятся в твердом состоянии, а при относительно высоких – в жидком и газообразном.
Пример. Температуры плавления и кипения (t, °С) некоторых веществ при атмосферном давлении, изменение энтальпии (DН0, кДж/моль) и энтропии (DS0, Дж/моль×К) при фазовых переходах.
| Вещество | Тип кристалла | Плавление | Кипение | ||||
| tпл, °С | DН0пл, | DS0 пл, | tкип, °С | DН0исп, | D S0исп, | ||
| N2 | Молекулярный | -210 | 0,721 | 11,4 | -195,8 | 5,59 | 72,4 |
| CH4 | -//- | -182,5 | 0,938 | 10,4 | -164 | 8,18 | 75,0 |
| H2O | -//- | 6,013 | 22,0 | 40,683 | 109,07 | ||
| C6Н6 | -//- | 5,5 | 9,837 | 35,3 | 80,1 | 30,76 | 87,1 |
| Si | Ковалентный | 49,8 | 29,5 | 99,6 | |||
| AgCl | Ионный | 13,2 | 18,1 | 100,5 | |||
| NaCl | -//- | 28,2 | 26,3 | 78,3 | |||
| MgF2 | -//- | 37,8 | 107,7 | ||||
| Na | Металлический | 97,9 | 2,60 | 7,01 | 90.1 | 77,7 | |
| Ag | -//- | 960,5 | 11,3 | 9,2 | 102,9 | ||
| W | -//- | 35,1 | 9,5 | 129,3 |
При нагревании происходит, как правило, последовательный переход веществ из твердого в жидкое и газообразное состояние (плавление и испарение), а при охлаждении протекают обратные процессы (конденсация и кристаллизация). Эти переходы осуществляются при определенной температуре (температуре фазового перехода), при этом скачкообразно изменяется молярный объем вещества и энтропия (энергетическая характеристика степени разупорядоченности системы), поглощается или выделяется тепловая энергия (энтальпия фазового перехода). Температура перехода из одного состояния в другое зависит от химической природы вещества и давления. Конкретные значения температур фазовых переходов для различных веществ лежат в широких пределах. Необходимо отметить, что при определенных условиях возможен фазовый переход твердое состояние – газ (сублимация).
Жидкое и твердое агрегатные состояния относят к конденсированному состоянию вещества. Оно отличается от газообразного тем, что энергия взаимодействия между частицами, образующими вещество, сравнима по величине или превышает энергию их теплового движения. Это приводит к тому, что в конденсированном состоянии среднее расстояние между частицами (между центрами частиц) сравнимо с их диаметром, тогда как в газе при нормальных условиях оно составляет величину ~ 10 их диаметров. Молярный объем любого газа при нормальных условиях равен Vn = 22,4 л/моль, тогда как молярные объемы твердых веществ и жидкостей примерно в 103 раз меньше (Vn = 0,01–0,05 л/моль).
 Пример. Расчет средних размеров пространства, занимаемого одной частицей при атмосферном давлении.
Пример. Расчет средних размеров пространства, занимаемого одной частицей при атмосферном давлении.
Газ. 1 моль газа при нормальных условиях занимает объем Vn = 22,4 л/моль и содержит 6,02×1023 молекул (число Авогадро).
Средний размер пространства, занимаемого одной частицей:
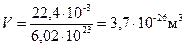 ,
, 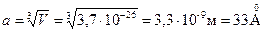 .
.
Размер молекулы азота (две длины связи) d N2 ~3 Å.
Жидкость. 1 моль жидкого брома (Br2) занимает объем 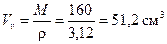 – молярный объем. М=160 г/моль – молярная масса брома, r=3,12 г/см3 – плотность жидкого брома.
– молярный объем. М=160 г/моль – молярная масса брома, r=3,12 г/см3 – плотность жидкого брома.
Средний размер пространства, занимаемого одной частицей:
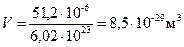 ,
, 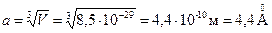 .
.
Размер молекулы брома (две длины связи) d Br2 ~ 4,56 Å.
Кристалл. 1 моль металлического серебра занимает объем 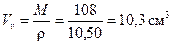 – молярный объем. М=108 г/моль – молярная масса серебра, r=10,50 г/см3 – плотность металлического серебра.
– молярный объем. М=108 г/моль – молярная масса серебра, r=10,50 г/см3 – плотность металлического серебра.
Средний размер пространства, занимаемого одной частицей:
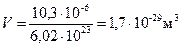 ,
, 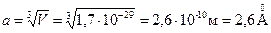 .
.
Размер атома серебра (два металлических радиуса) d Ag ~ 2,68 Å.
В газах частицы находятся в броуновском движении, при этом отсутствуют ближний и дальний порядок в положении частиц. Газ не имеет собственного объема и, соответственно, формы. В жидкостях броуновское движение осложнено наличием более или менее устойчивого ближнего порядка в положении частиц относительно друг друга за счет возникновения химических связей между отдельными частицами. Жидкость имеет собственный объем, но из-за слабого межмолекулярного взаимодействия под действием силы тяжести принимает форму сосуда, в котором она находится. В твердом состоянии вещества энергия взаимодействия между частицами намного превышает энергию теплового движения, что приводит к фиксированию положений частиц в пространстве, вокруг которых они совершают колебательные и вращательные движения. Это определяет наличие у твердых тел собственной формы и объема и большое сопротивление сдвигу.
Сравнение энергетических характеристик фазовых переходов свидетельствует о существенно меньшей перестройке вещества при плавлении, чем при испарении. Как было показано в примере, для всех кристаллов с различным типом химической связи теплота (энтальпия) плавления много меньше теплоты испарения. Энтропия фазового перехода, характеризующая изменение степени упорядоченности системы, также для плавления много меньше, чем для испарения.
В газообразном состоянии, где присутствуют слабо или совсем не взаимодействующие между собой молекулы вещества, химическая связь внутри них рассматривается с использованием моделей «классической» ковалентной связи.
При рассмотрении конденсированного состояния вещества химическую связь описывают с использованием моделей ковалентной, ионной и металлической связи. При этом необходимо принимать во внимание близкое расположение частиц, образующих систему. Это обстоятельство в ряде случаев (жидкости, молекулярные кристаллы) обусловливает необходимость учитывать существенный вклад межмолекулярного взаимодействия в энергию химических связей.
Необходимо отметить, что целый ряд веществ может не иметь одного из агрегатных состояний. Чаще всего это относится к жидкому и газообразному состояниям. Данное обстоятельство связано с соотношением между энергией, необходимой для перевода вещества из одного агрегатного состояния в другое, и энергией, достаточной для разрыва внутримолекулярных химических связей. Например, во многих нерастворимых в воде гидроксидах металлов при нагревании раньше протекает реакция дегидратации (Cu(OH)2® CuO + H2O), а затем происходит плавление вещества.
Дата добавления: 2017-02-20; просмотров: 901;
