Полярность связи и дипольный момент молекулы
 При образовании ковалентной химической связи между разными атомами (гетероядерные молекулы) электронная плотность распределяется не симметрично относительно ядер. В молекуле она сдвинута в сторону атома, имеющего большее значение электроотрицательности. Вследствие этого в двухатомной молекуле центры тяжести положительных зарядов ядер и отрицательных зарядов электронов не совпадают. Возникает система разных по знаку, но одинаковых по величине электрических зарядов (d+ и d-) – электрический диполь (рис. 3.23).
При образовании ковалентной химической связи между разными атомами (гетероядерные молекулы) электронная плотность распределяется не симметрично относительно ядер. В молекуле она сдвинута в сторону атома, имеющего большее значение электроотрицательности. Вследствие этого в двухатомной молекуле центры тяжести положительных зарядов ядер и отрицательных зарядов электронов не совпадают. Возникает система разных по знаку, но одинаковых по величине электрических зарядов (d+ и d-) – электрический диполь (рис. 3.23).
Рис. 3‑23 Схема образования диполя
Мерой полярности связи (характеристикой диполя) является дипольный момент m – произведение величины заряда d на расстояние между центрами тяжести положительных и отрицательных зарядов (длина диполя l).
Единицей измерения дипольного момента в системе СИ [КлЧм] чаще используется внесистемная единица Дебай (D): 1 D = 3,33Ч10-30 КлЧм.
В гетероядерных молекулах связь всегда полярна, но если число атомов в молекуле три и более, то возникающая при этом система распределения зарядов может привести к тому, что молекула в целом не будет являться диполем – центры тяжести положительных и отрицательных зарядов совпадают. Как правило, это связано с симметричным строением молекулы.
 Пример.1 Молекула воды H2O.
Пример.1 Молекула воды H2O.
Пример.2 Молекула воды CO2.

Если молекулу, даже если она не является диполем, поместить в электрическое поле напряженностью Е, происходит разделение центров тяжести зарядов в результате смещения электронов относительно ядер, и смещения атомов относительно друг друга в молекуле. При этом молекула приобретает наведенный (индуцированный) дипольный момент. Способность молекул приобретать в электрическом поле дипольный момент называется поляризуемостью.
Дипольный момент наведенного диполя пропорционален напряженности электрического поля: 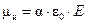 , где a– коэффициент поляризуемости (поляризуемость) атома или молекулы, e0 – электрическая постоянная.
, где a– коэффициент поляризуемости (поляризуемость) атома или молекулы, e0 – электрическая постоянная.
Контрольные вопросы.
1. Основные параметры химической связи. Типы химической связи.
2. Ковалентная химическая связь − основные принципы метода валентной связи.
3. Типы перекрывания валентных орбиталей. Кратность связи.
4. Геометрия простейших молекул. Гибридизация АО.
5. Донорно-акцепторный механизм образования ковалентной связи.
6. Ковалентная химическая связь − метод молекулярных орбиталей. Связывающие и разрыхляющие орбитали.
7. Энергетические диаграммы двухатомных молекул. Электронные конфигурации молекул.
8. Полярность связи и дипольный момент молекулы.
Дата добавления: 2017-02-20; просмотров: 1229;
