Кратные связи. s- и p-связи
Единичная химическая связь представляет собой общую электронную пару, локализованную в области перекрывания валентных орбиталей, что приводит к образованию области повышенной электронной плотности, расположенной между ядрами атомов.
Если область повышенной электронной плотности располагается симметрично линии, проходящей через ядра взаимодействующих атомов (линии связи), то такой тип связи называется s-связью. Она принципиально может образовываться в результате перекрывания любого типа атомных орбиталей (рис. 3.5).

Рис. 3‑5 Схема образования s-связи
Поскольку s-связь обладает цилиндрической симметрией, то поворот атомов относительно друг друга вокруг линии связи не приводит к изменению распределения электронной плотности. Поэтому оба атома могут свободно вращаться вокруг оси, совпадающей с линией связи, не разрывая и не деформируя s-связь.
Примечание. Волновые функции, описывающие атомные орбитали, могут иметь области положительных и отрицательных значений – знак функции. Функция, описывающая s-орбиталь, во всей области пространства положительна (рис. 3.6, а). Функции, описывающие p- и d- орбитали, имеют узловые точки (точки в которых функция обращается в ноль). При переходе через узловую точку волновая функция меняет свой знак на противоположный, то есть имеются области орбиталей с отрицательным и положительным знаком волновых функций (рис. 3.6, б, в).
Область повышенной электронной плотности (образование связи) возникает в том случае, если перекрываются электронные орбитали, функции которых имеют одинаковый знак. Поэтому, например, перекрывание s- и py-или pz-орбитали(направление оси x совпадает с линией связи) не приводит к образованию химической связи (рис. 3.6, г). Связь образуется при перекрывании s- и положительной части px-орбитали (рис. 3.6, д).

Рис. 3‑6 Области орбиталей с отрицательным и положительным знаком волновых функций
Электроны, имеющие сложную симметрию орбиталей (p- и d-орбитали), могут образовывать связь в результате перекрывания орбиталей в двух областях над и под линией связи. Такой тип связи называется p-связью (рис. 3.7).
Энергия p-связи меньше, чем энергия s-связи, так как перекрывание орбиталей по p-типу меньше, чем по s-типу. p-связь не обладает цилиндрической симметрией относительно линии связи, поэтому вращение атомов вокруг линии связи исключено, что объясняет существование цис- и транс-изомеров.
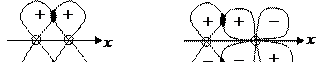
Рис. 3‑7 Схема образования p-связи
При образовании химической связи между двумя атомами в первую очередь образуется s-связь. Во многих случаях она будет единственной, но если атомы имеют дополнительно неспаренные р-электроны, то кроме s-связи может образоваться одна или две p-связи, которые будут располагаться во взаимно перпендикулярных плоскостях. В этом случае говорят о кратности связи – двойная связь (s- и одна p-связь) или тройная связь (s- и две p-связи), которые образованны соответственно двумя или тремя электронными парами (рис. 3.8).
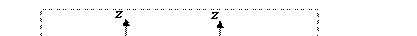
Рис. 3‑8 Схема образования кратных связей: py-py – одна s-связь, px-px, pz-pz – две p-связи
С увеличением кратности связи увеличивается энергия связи и уменьшается ее длина.
Пример. Характеристики химических связей различной кратности:
| Связь | Кратность | Энергия, кДж/моль | Длина, Ǻ |
| C-C | Простая | 1,54 | |
| C=C | Двойная | 1,34 | |
| CºC | Тройная | 1,20 | |
| F-F | Простая | 1,42 | |
| O=O | Двойная | 1,21 | |
| NºN | Тройная | 1,10 | |
| Cl-Cl | Простая | 1,99 | |
| Br-Br | Простая | 2,28 |
Дата добавления: 2017-02-20; просмотров: 1263;
