Основные параметры химической связи
Рассмотрим процесс образования молекулы АВ из атомов А и В. На рис. 3.1 приведена зависимость энергии системы, состоящей из двух взаимодействующих атомов А и В, в зависимости от расстояния между ними. Из рисунка видно, что на большом расстоянии между атомами (ядрами атомов) (r ® ¥) взаимодействия между ними нет: DЕ = ЕАВ – (ЕА + ЕВ) = 0. При сближении атомов энергия системы будет понижаться на величину энергии притяжения Епр и повышаться на величину энергии отталкивания Еот. В первом приближении описание зависимостей энергий от расстояния аналогично описанию взаимодействия системы точечных зарядов. Тогда
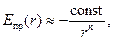
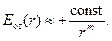
Известно, что энергия отталкивания сильнее зависит от расстояния, чем энергия притяжения, то есть m>n. Результирующая, суммарная кривая изменения энергии системы в зависимости от расстояния между ядрами атомов DЕ(r) = Епр(r) + Еот(r) будет иметь сложную форму с минимумом на расстоянии r = rсв.

Рис. 3‑1. Зависимость энергии электростатического взаимодействия двух атомов от расстояния между ними
Максимальная величина уменьшения энергии системы называется энергией химической связи. Как правило, энергия химической связи выражается в эВ для образования одной молекулы или в кДж/моль для одного моля молекул: Eсв[кДж/моль] = Eсв[эВ]×ē×NА×10-3 (ē – заряд электрона, NА – число Авогадро), Eсв[кДж/моль] = 96,3×Eсв[эВ].
Расстояние между ядрами взаимодействующих атомов, на котором энергия системы минимальна, а силы притяжения равны силам отталкивания, называетсядлиной химической связи (rсв). В реальных молекулах она составляет величину порядка нескольких единиц ангстрем (Å).
Для трех- и более атомных молекул энергия связи зависит не только от расстояния между соседними атомами, но и от их взаимного расположения. Поэтому третьей характеристикой химической связи (для молекул, состоящих из трех и более атомов) является угол связи (валентный угол) – угол a между воображаемыми прямыми, проходящими через ядра атомов. В этом случае энергия системы (молекулы) будет функцией нескольких переменных: DE=f(ri,ai). Валентные углы дают важную информацию о направленности химической связи и тем самым о геометрическом строении молекулы.
 Пример 1. Молекула диоксида углерода (CO2): длина связи rC-О = 1,16 Å, угол связи ÐO-C-O = 180о, энергия связи ЕC-O = 800 кДж/моль.
Пример 1. Молекула диоксида углерода (CO2): длина связи rC-О = 1,16 Å, угол связи ÐO-C-O = 180о, энергия связи ЕC-O = 800 кДж/моль.
Пример  2. Молекула диоксида серы(SO2): длина связи rS-О = 1,43 Å, угол связи ÐO-S-O = 119,3о, энергия связи ЕS-O = 528 кДж/моль.
2. Молекула диоксида серы(SO2): длина связи rS-О = 1,43 Å, угол связи ÐO-S-O = 119,3о, энергия связи ЕS-O = 528 кДж/моль.
Параметры химической связи – энергия, длина, угол – относятся к равновесной конфигурации молекулы, состоянию с минимальным значением ее энергии (E(ri,ai)).
В действительности атомы совершают колебательные движения около положения равновесия: увеличение – уменьшение длины связи (валентные колебания); увеличение – уменьшение угла связи (деформационные колебания). Амплитуда колебаний увеличивается с ростом температуры, при этом уменьшается DЕ системы, и при определенной температуре связь разрывается, происходит диссоциация молекулы. Необходимо отметить, что изменение энергии системы вследствие колебаний квантовано, то есть может принимать только дискретные разрешенные значения.
Важную роль при описании взаимодействия атомов в молекуле, а особенно при описании взаимодействия молекул друг с другом играет взаимное влияние электронов и ядер атомов, приводящее к смещению центров положительных и отрицательных зарядов (поляризация связи). На отдельных атомах возникают противоположные по знаку электрические заряды +d и –d. Величина и знак электрического заряда будет зависеть от разности электроотрицательностей атомов, образующих молекулу.
Дата добавления: 2017-02-20; просмотров: 1020;
