Физико-химические характеристики атома
Физико-химические характеристики атома, такие как энергия ионизации, энергия сродства к электрону, электроотрицательность, атомные и ионные радиусы, позволяют объяснять и предсказывать некоторые химические свойства элементов. Эти характеристики закономерно изменяются с ростом заряда ядра атомов и подобны для элементов с повторяющимися электронными структурами.
1. Радиус атома и иона. Поскольку атомы и ионы не имеют четкой геометрической границы, невозможно выделить и измерить отдельный атом. Эти характеристики рассчитывают исходя из предположения, что атомы и ионы в соединениях, кристаллах и т.д. представляют собою твердые шары, которые упакованы плотнейшим образом.
Ковалентный радиус – половина экспериментально определяемого расстояния между ядрами двух одинаковых атомов, образовавших простую ковалентную молекулу.
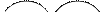 Пример. Длина химической связи (расстояние между ядрами атомов) в молекуле H2 составляет величину rсв= 0,74 Å, ковалентный радиус равен:
Пример. Длина химической связи (расстояние между ядрами атомов) в молекуле H2 составляет величину rсв= 0,74 Å, ковалентный радиус равен: 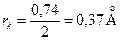 .
.
Ионный радиус рассчитывают из экспериментально определяемых параметров кристаллической решетки, но расчет более сложен, так как размеры катионов и анионов разные.
Общие закономерности: в периоде радиус атома уменьшается (увеличение заряда ядра приводит к сжатию орбиталей). В группе радиус увеличивается с увеличением числа электронных слоев (рис. 2.20).

Рис. 2‑20 Зависимость атомного радиуса от заряда ядра
Катион по сравнению с атомом имеет меньший радиус, а анион больший: 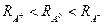 .
.
Пример.
| Частица | Na0 | Na+ | Sr0 | Sr+2 | Cl0 | Cl- | S0 | S-2 |
| Радиус в Å | 1,54 | 1,02 | 1,91 | 1,18 | 0,99 | 1,81 | 1,02 | 1,84 |
2. Энергия ионизации (Eи) – энергия, которую необходимо приложить к нейтральному невозбужденному атому для удаления электрона на бесконечность:  А0 – ē ® А+. Энергия ионизации характеризует энергию связи электрона в атоме.
А0 – ē ® А+. Энергия ионизации характеризует энергию связи электрона в атоме.
Энергия ионизации в многоэлектронном атоме может быть определена для каждого электрона. Первая энергия ионизации – удаление электрона из нейтрального атома, вторая – отрыв электрона от однозарядного иона и т. д. Теоретически, сколько электронов в атоме, столько и энергий ионизации: (Еи)n+1 > (Еи)n.
Общие закономерности изменения первой энергии ионизации элементов (рис. 2.21):
в периоде энергия ионизации увеличивается, но не монотонно. Атомы, имеющие полностью или наполовину заполненные энергетические состояния, имеют большее значение энергии ионизации, электрон связан сильнее;
в группе энергия ионизация падает вследствие увеличения радиуса атома и соответственно уменьшения энергии связи.

Рис. 2‑21 Зависимость первой энергии ионизации (1) и сродства к электрону (2) от заряда ядра атомов
|
|
|
|
|
В периоде энергия сродства к электрону увеличивается, а в группе уменьшается, хотя эти закономерности выглядят не так явно, как для энергии ионизации (рис. 2.21).
4. Электроотрицательность (χ) – характеристика элемента, показывающая способность атома притягивать к себе электронную плотность при образовании химической связи с другим элементом. Она позволяет оценивать вероятность распределения электронной плотности в молекулах химических соединений. Чем больше разница величин электроотрицательности атомов, образующих химическую связь, тем больше сдвигается электронная плотность к атому с большим значением электроотрицательности.
Разработано несколько способов оценки электроотрицательности атомов (шкалы элетроотрицательности) базирующихся на использовании различных экспериментальных или расчетных данных.
Наиболее ясный физический смысл имеет шкала по Малликену (Mulliken) – величина электроотрицательности атома пропорциональна полусумме энергии ионизации и энергии сродства к электрону: 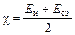 . Шкала Олреда-Рохова основана на вычислении силы электростатического взаимодействия ядра с эффективным зарядом (Zэ) и внешнего электрона (электрон на расстоянии равном ковалентному радиусу). Наибольшее распространение получила термохимическая шкала электроотрицательностей, разработанная Полингом (Pauling). В данном методе электроотрицательность атомов А и В определяют исходя из энергии связи в молекулах А-В, А-А и В-В.
. Шкала Олреда-Рохова основана на вычислении силы электростатического взаимодействия ядра с эффективным зарядом (Zэ) и внешнего электрона (электрон на расстоянии равном ковалентному радиусу). Наибольшее распространение получила термохимическая шкала электроотрицательностей, разработанная Полингом (Pauling). В данном методе электроотрицательность атомов А и В определяют исходя из энергии связи в молекулах А-В, А-А и В-В.
Относительные величины электроотрицательности атомов в различных шкалах хорошо согласуются друг с другом, за исключением небольших различий. Тем не менее, сравнение величин электроотрицательности атомов необходимо проводить в одной шкале.

Рис. 2‑22 Зависимость относительной электроотрицательности атомов (шкала Полинга) от заряда ядра.
Общие закономерности изменения электроотрицательности элементов в группах и периодах Периодической системы не зависят от способа их определения. А именно: электроотрицательность в периоде растет, а в группе уменьшается. Максимальной электроотрицательностью обладают элементы, расположенные в правом верхнем углу (фтор, кислород, азот, хлор), минимальной – в левом нижнем углу (цезий, рубидий, барий) периодической таблицы (рис. 2-22).
Контрольные вопросы.
1. Особенности квантово-механического описания электрона в потенциальном ящике.
2. Энергетическое состояние электрона в атоме. Квантовые числа. Атомные орбитали.
3. Орбитали многоэлектронных атомов.
4. Правила заполнения орбиталей электронами. Спин. Электронная конфигурация атомов.
5. Связь электронной конфигурации атома с его положением в периодической таблице элементов.
6. Валентные электроны. Периодический закон Д.И. Менделеева и его связь с электронным строением атомов.
7. Физико-химические характеристики атомов.
ХИМИЧЕСКАЯ СВЯЗЬ
Отдельные атомы химических элементов, не взаимодействующие друг с другом, в природе практически не встречаются. Как правило, мы имеем дело с более или менее устойчивыми образованиями, состоящими из двух и более одинаковых или различных атомов. Ими могут быть молекулы, сложные радикалы и ионы, входящие в состав газообразных, жидких и твердых веществ. В этом случае говорят, что между атомами в частицах существует химическая связь. Какие силы при этом действуют, что обеспечивает устойчивость образовавшихся частиц – эти вопросы решаются теорией химической связи.
Атомы будут объединяться, образовывая устойчивые системы, в случае понижения полной энергии многоатомной системы по сравнению с энергией изолированных атомов (принцип минимума энергии). Например, условием образования молекулы АВ из атомов А и В является
ЕАВ < ЕА + ЕВ, DЕ = ЕАВ – (ЕА + ЕВ) < 0,
где ЕА, ЕВ – полная энергия изолированных атомов, ЕАВ – энергия молекулы, DЕ – изменение энергии системы при образовании молекулы.
Химическая связь обусловлена наличием сил притяжения и отталкивания, удерживающих атомы на определенном расстоянии друг от друга. Атомы содержат отрицательно (электроны) и положительно заряженные (ядра) частицы. Таким образом, природа этих сил обусловлена взаимодействием зарядов (носит электромагнитный характер). Образование химической связи происходит в результате взаимодействия электронных оболочек и ядер атомов и сопровождается уменьшением полной энергии системы. При этом существенно не изменяется электронное строение атомов – сохраняются ядра атомов и общая структура электронных оболочек. При образовании химической связи происходит только перераспределение электронной плотности внешних электронов. В зависимости от характера этого перераспределения используют различные модели описания химических связей.
Дата добавления: 2017-02-20; просмотров: 1942;
