Квантово-механическое рассмотрение химической связи.
Ковалентная связь
Получить ответ, удовлетворительно объясняющий природу и механизм химической связи, оказалось возможным только после появления квантово-механической теории строения атома, так как при образовании связи проявляются специфические для микрообъектов свойства электронов.
С точки зрения квантовой механики при образовании химической связи между атомами их электронные орбитали перекрываются. В результате в межъядерной области создается повышенная электронная плотность по сравнению с электронной плотностью в изолированных атомах, которая как бы стягивает ядра в единую устойчивую систему (рис.1, а). В силу особенностей электронных состояний между ядрами может происходить не повышение электронной плотности, а, наоборот, уменьшение ее до нуля. В этом случае химическая связь не образуется (рис. 1, б). Причины устойчивости многоатомной частицы заключаются в понижении энергии ее образования. Рассмотрим, например, изменение энергии при сближении двух атомов водорода, находящихся на бесконечно большом расстоянии (r = ∞) друг от друга. Потенциальную энергию Е при г = ∞ примем равной нулю.
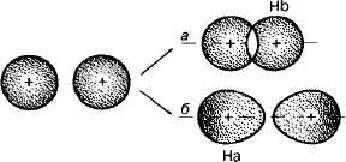
Рис.1 Взаимодействие между атомами водорода, приводящее к образованию связи (а) и не приводящее к образованию связи (б)
Система состоит из двух протонов и двух электронов. Между частицами возникает два типа сил: силы отталкивания между электронами двух атомов и протонами атомов и силы притяжения между протонами и электронами.
Квантово-механическое рассмотрение химической связи.
Ковалентная связь
Если спины электронов антипараллельны, то при сближении атомов происходит уменьшение потенциальной энергии системы и при r= r0 силы притяжения становятся равными силам отталкивания, а энергия системы принимает свое минимальное значение. При дальнейшем сближении атомов силы отталкивания будут больше сил притяжения и потенциальная энергия системы начинает резко возрастать. Графическая зависимость потенциальной энергии системы из двух атомов водорода от межъядерного расстояния, называемая ПОТЕНЦИАЛЬНОЙ КРИВОЙ, представлена на рис.2.
Таким образом, при сближении двух атомов водорода с электронами, обладающими антипараллельными спинами, на расстояние r0 система имеет минимальную энергию и, следовательно, в этом случае образуется устойчивая химическая связь (рис. 2, а).
В случае, когда спины параллельны, квантово-механические расчеты по уравнению Шредингера показывают, что потенциальная энергия системы при любом расстоянии между сближающимися атомами больше, чем сумма энергий двух отдельных атомов и образование химической связи невозможно. Потенциальная кривая в данном случае выглядит иначе (рис. 2, б).
В заключение отметим, что в рамках этой модели ядро атома не закрепляется неподвижно в точке О, а постоянно колеблется. В реальной же двухъядерной молекуле колеблются оба ядра, достигая определенных предельных состояний. Молекулы все время как бы растягиваются и сжимаются. При этом го — среднее расстояние между ядрами, а Еmin — минимальная энергия молекулы с учетом колебания ядер.
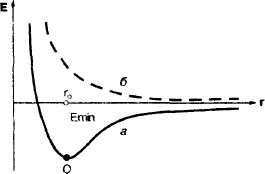
Рис 2. потенциальная кривая
Количественные характеристики химической связи
Химическая связь характеризуется рядом параметров. Чаще всего говорят об ее энергии и длине. Если молекула состоит из трех и более атомов, то к перечисленным параметрам добавляют еще один — валентные углы.
ЭНЕРГИЕЙ СВЯЗИ называют ту энергию, которую необходимо затратить для ее разрыва. При этом молекула должна находиться в основном (невозбужденном) состоянии и при 0оК. Эта величина определяет прочность связи. Чем больше энергия, затрачиваемая на разрыв связи, тем прочнее связь. Единица измерения энергии связи — кДж/моль. Например, энергия связи Н—Н в молекуле водорода равна 436 кДж/моль. Если в молекуле несколько одинаковых связей, то, очевидно, для разрушения каждой следующей потребуется различная энергия и в таком случае говорят о средней энергии связи.
Величина энергии химических связей в большинстве соединений колеблется в пределах 100-1000кДж/моль. Энергия связи в ряду однотипных молекул постепенно изменяется. Например, энергия связи Н-Г в ряду гало-геноводородов HF, HC1, HBr, HI уменьшается с 565,7 кДж/моль у HF, до 294,7 кДж/моль у HI. Зная энергию связей в молекуле, можно судить также о ее реакционной способности и производить различные термохимические расчеты.
ДЛИНОЙ СВЯЗИ называют среднее расстояние между ядрами, отвечающее минимуму энергии системы. На рис. 2. длина связи между атомами водорода измеряется отрезком гo. Современными методами исследования структуры веществ можно определить длины связей с точностью, которую допускает принцип неопределенности.
В ряду аналогичных по составу молекул длины связей также изменяются закономерно. Например, в ряду HF, НС1, HBr, HI длина связи увеличивается с возрастанием размера атома и соответственно равна 0,091; 0,127; 0,141; 0,160нм. Вмолекулах, близких по химической природе, одного гомологического ряда, длины связей между ядрами элементов мало различаются и могут считаться практически постоянными (например, длины связей С - С в предельных углеводородах и т. д.).
Кроме того, на длину связи влияет ее кратность, которая определяется числом электронных пар, связывающих два атома. С увеличением кратности связей происходит их упрочнение, межъядерные расстояния уменьшаются. Так, длина связи С—С равна 0,154 нм, С = С - 0,135 нм и С ≡ С - 0,121 нм.
ВАЛЕНТНЫЕ УГЛЫ. Это углы между связями в молекуле. Их схематически можно представить как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые, проведенные через два ядра, называют линиями связи. Величины валентных углов зависят от природы атомов и характера связи. Простые двухатомные молекулы всегда имеют линейную структуру. Трехатомные и более сложные молекулы могут обладать различными конфигурациями. Например, в молекуле воды угол между линиями связи Н—О равен 104,5°, а в сходной молекуле сероводорода валентный угол между связями составляет 92°.
Все рассмотренные параметры химической связи можно определить экспериментально при исследовании молекулярных спектров веществ. Их также, в боль
Для описания и расчета ковалентной связи широко используются два метода — метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Дата добавления: 2018-06-28; просмотров: 948;
