Применение электролиза
Извлечение из сплавов (электрорафинирование):
Получение металлов: криолит-глиноземный расплав ( 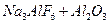 )
)
Получение металлических порошков с заданными свойствами
Размер частиц,
Получение сплавов: свинец-натрий-калий
Получение неорганических и органических веществ
Электрохимическая полировка
Гальванопластика Целью гальванопластики является воспроизведение формы предмета посредством электролитического осаждения металлов.
Электролитическое оксидилирование (анодирование) на примере алюминия
ХИТы делятся на три типа: первичные (гальванические элементы), вторичные (аккумуляторы) и топливные элементы. Гальванический элемент уже был рассмотрен
Свинцовый аккумулятор
высокообратимая химическая реакция окисления-восстановления, которую можно проводить как в прямом направлении (переход химической энергии в электрическую, также как в гальваническом элементе), так и в обратном (проведение процесса электролиза от внешнего источника постоянного тока, когда электрическая энергия превращается в химическую).
В кислотном аккумуляторе решетчатые свинцовые пластины обмазаны пастой, состоящей из 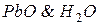 , и опущены в 25-30% раствор серной кислоты. В результате реакции
, и опущены в 25-30% раствор серной кислоты. В результате реакции 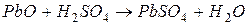 электроды покрываются твердым налетом сульфата свинца. Гальваническая цепь незаряженного аккумулятора выглядит следующим образом:
электроды покрываются твердым налетом сульфата свинца. Гальваническая цепь незаряженного аккумулятора выглядит следующим образом: 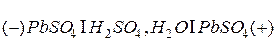
При заряде такого аккумулятора происходят следующие процессы:
катод 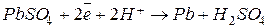
анод 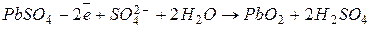
В результате этого процесса гальваническая цепь 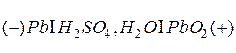
При разряде такого аккумулятора протекают реакции:
катод 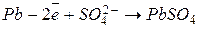
анод 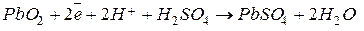
Топливным элементом называется ХИТ длительного действия, начинающий и прекращающий работу с началом и прекращением подачи активных веществ к электродам.
водородно-кислородный топливный элемент, разработанный Бэконом в 1946 году
Катод - никелевый сплав с платиновым катализатором
Анод - сплавы серебра.
Электролит - 27% раствор 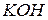 или 25-30% раствор
или 25-30% раствор 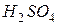 при температуре около 240 0С.
при температуре около 240 0С.
При этом в щелочном электролите будут протекать следующие процессы:
катод 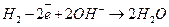
анод 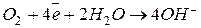 .
.
Если электролит будет кислотным, то:
катод 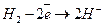
анод 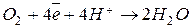 .
.
Коррозия: равномерная (общая), местная (точечная), межкристаллическая, транскристаллическая.
химическая и электрохимическая.
Химическая: среда не проводит электрический ток, газовая, р-ры неэлектролитов (нефть) 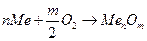
Термодинамика: 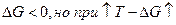
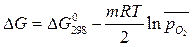
Кинетика 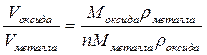
< 1 – пленка не является сплошной
> 1 – по мере утолщения рост замедляется
Электрохимическая (анодное растворение металла) – среда с ионной проводимостью
Коррозия с поглощением кислорода
Нейтральная и щелочная 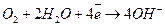
Кислая: 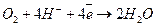
Коррозия с выделением водорода (кислая) 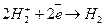
Защита от коррозии:
1. Легирование металлов (хром, никель, вольфрам): жаростойкость и жаропрочность
2. Защитные покрытия: металлические и неметаллические (лаки, краски, эмаль).
Металлические:
Катодные (медь, никель, хром) Анодные (цинк)
Почвенная коррозия – разрушение металла или бетона в почве. Ежегодные потери металла вследствие протекания почвенной коррозии достигают 4%.
Почвенной коррозии подвергаются различного назначения трубопроводы, резервуары, сваи, опоры, кабеля, обсадные трубы скважин, всякого рода металлоконструкции, эксплуатируемые в почве.
Почвенная коррозия почти всегда протекает по электрохимическому механизму (исключения составляют лишь очень сухие грунты).
Анодный процесс при почвенной коррозии – разрушение металла. На катоде же проходит кислородная деполяризация.
В деаэрированной (освобожденной от кислорода воздуха) нейтральной и щелочной среде (рН>7) деполяризация протекает с участием воды:
(+) К: 2Н2О + 2е- = Н2↑ +2ОН-
В деаэрированной кислой среде (рН<7) деполяризация протекает с участием катионов водорода:
(+)К: 2Н+ + 2е- = Н2↑
В аэрированной (насыщенной кислородом воздуха) нейтральной и щелочной среде (рН>7) деполяризация протекает с участием кислорода и воды:
(+) К: О2 + 2Н2О + 4е- = 4ОН-
В аэрированной (насыщенной кислородом воздуха) кислой среде (рН<7) деполяризация протекает с участием кислорода и катионов водорода:
(+) К: О2 + 4Н+ + 4е- = 2Н2О
Подземную коррозию делят на грунтовую коррозию и электрокоррозию (коррозию блуждающими токами). Подземная коррозия менее опасна, чем разрушение под воздействием блуждающих токов.
Особенности почвенной коррозии металлов:
- значительное влияние омического сопротивления грунта;
- возникновение коррозионных микро и макропар;
- язвенный характер разрушения.
Под воздействием кислот коррозия бетона протекает либо с увеличением его объема, либо с вымыванием легкорастворимых известковых соединений.
Увеличение объема происходит по реакции:
Ca(OH)2 + CO2 = CaCO3 + H2O
CaCO3 не растворяется в воде. Постепенно происходит его отложение в порах цементного камня, за счет чего идет увеличение объема бетона, а в дальнейшем его растрескивание и разрушение.
При контакте бетона с водными растворами кислот образуется легкорастворимый бикарбонат кальция, который агрессивный для бетона, а при наличии воды растворяется в ней и постепенно вымывается из структуры бетонного камня. Образование бикарбоната кальция описывается реакцией:
CaCO3 + CO2 + H2O = Ca(HCO3)2.
Помимо растворения наблюдается и протекание химической коррозии бетона:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O,
при этом вымываются соли хлористого кальция.
Дата добавления: 2018-03-01; просмотров: 823;
