ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ.
Электрохимия – это раздел физической химии, занимающийся изучением связи между электрическими и химическими процессами.
Химический процесс, условия протекания:
1. только при столкновении реагирующих частиц, когда становится возможным переход электронов (от восстановителя (цинк) к окислителю (медь));
2. путь электрона очень мал;
3. электронные переходы могут осуществляться в любых направлениях в пространстве, процесс хаотичен.
Результат – тепловой эффект химической реакции.
Электрохимический процесс, условия протекания:
1. восстановитель и окислитель должны быть разделены, а электроны должны передаваться от восстановителя к окислителю по одному общему пути перехода;
2. поток электронов должен быть непрерывным, значит, необходима реакционная среда;
3. поток электронов является строго направленным.
Для соблюдения этих трёх условий необходимо собрать электрическую цепь.
Поместим цинковую и медную пластинку в растворы их сульфатов.
В данных металлических пластинках, согласно представлениям о металлической связи, происходят следующие процессы:
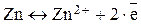
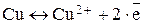
В тоже время соли металлов (вспомните, пожалуйста, тему ВИДЫ ХИМИЧЕСКИХ СВЯЗЕЙ) представляют собой вещества, которые в растворителе диссоциируют с образованием положительно заряженных ионов металла и отрицательно заряженных ионов кислотного остатка:
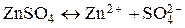
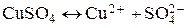
Из металла часть ионов, обладающих высокой энергией теплового движения, переходит в раствор, чему способствует их взаимодействие с полярными молекулами растворителя. Одновременно происходит обратный процесс: разрушение сольватной оболочки ионов металла, находящихся в растворе, и их включение в кристаллическую решетку металла. Результирующее уравнение этих процессов выглядит следующим образом:
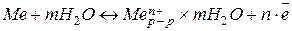
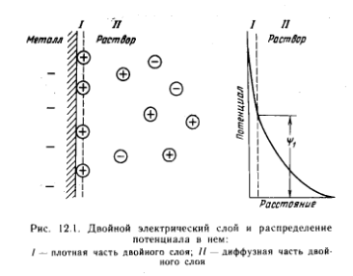
Первоначально в растворе преобладает прямая реакция, в результате которой раствор заряжается положительно, а металл - отрицательно. Но, любая химическая система устойчива только в состоянии электронейтральности. Поэтому, ионы раствора, несущие избыточный положительный заряд, и нескомпенсированные электроны в пластине металла притягиваются друг к другу. В результате этого они располагаются на границе раздела фаз (раствор/металл) по обе стороны от нее, образуя т.н. двойной электрический слой, характеризующийся определенным скачком потенциала – электродным потенциалом.
 Возникающее при этом электрическое поле затрудняет растворение металла и усиливает обратный процесс. В дальнейшем устанавливается динамическое равновесие, обусловленное взаимной компенсацией этих процессов, и определенная разность потенциалов между пластиной металла и раствором его соли.
Возникающее при этом электрическое поле затрудняет растворение металла и усиливает обратный процесс. В дальнейшем устанавливается динамическое равновесие, обусловленное взаимной компенсацией этих процессов, и определенная разность потенциалов между пластиной металла и раствором его соли.
Т.о., двойной электрический слой – положительно заряженный пограничный слой жидкости, возникающий на поверхности металла, опущенного в растворитель. Следует отметить, что толщина двойного слоя в растворе зависит от концентрации раствора, температуры, заряда металла, а ее величина колеблется в интервале от нескольких ангстрем до микрона.
Характер изменения потенциала в двойном электрическом слое позволяет выделить в нем плотную и диффузную части. Плотная часть двойного электрического слоя (т.н. слой Гельмгольца) образована ионами, находящимися на минимальном расстоянии от поверхности раздела фаз. Такой слой подобен конденсатору с металлическими обкладками. Потенциал в нем меняется линейно.
Диффузная часть двойного электрического слоя (слой Гюи) соответствует конденсатору, одна из обкладок которого как бы “размыта”. Этой обкладке отвечают ионы, отошедшие вглубь раствора вследствие их теплового движения. С удалением от раздела фаз количество избыточных ионов быстро убывает, и раствор становится нейтральным. Межфазный скачок потенциала представляет собой сумму скачков в слоях Гельмгольца и Гюи.
Стандартным (или нормальным) электродным потенциалом ( 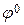 ) называется потенциал электрода в растворе, в котором ионы, определяющие электродный процесс, имеют активность, равную единице. Величина
) называется потенциал электрода в растворе, в котором ионы, определяющие электродный процесс, имеют активность, равную единице. Величина 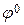 измеряется относительно нормального водородного электрода, потенциал которого условно принимается равным нулю.
измеряется относительно нормального водородного электрода, потенциал которого условно принимается равным нулю.
Нормальный водородный электрод выглядит следующим образом:
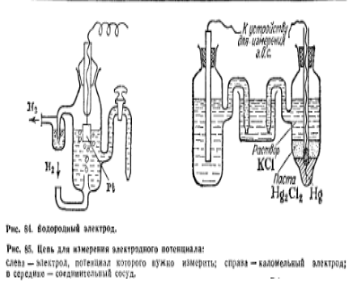 Он представляет собой платиновую пластинку, электролитически покрытую губчатой платиной (платиновой чернью) и погруженную в раствор кислоты, через которую пропускается водород. Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются атомы. На поверхности соприкосновения платины с раствором кислоты может протекать окисление атомов или восстановление ионов водорода:
Он представляет собой платиновую пластинку, электролитически покрытую губчатой платиной (платиновой чернью) и погруженную в раствор кислоты, через которую пропускается водород. Водород хорошо растворяется в платине; при этом молекулы водорода частично распадаются атомы. На поверхности соприкосновения платины с раствором кислоты может протекать окисление атомов или восстановление ионов водорода:

Поскольку потенциал водородного электрода воспроизводится с большой точностью, он был принят за эталон при создании шкалы электродных потенциалов и условно, как уже было отмечено выше, приравнен к нулю. Активность ионов водорода 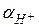 при этом принимается равной 1.
при этом принимается равной 1.
Значения стандартных электродных потенциалов Е0 сведены в таблицу. Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получаем так называемый ряд «напряжений металлов». Положение металла в этом ряду характеризует его восстановительную способность. Металл с более отрицат. потенциалом может вытеснять металл с менее отрицат. потенциалом из р-ров его солей, растворяясь при этом. Электродному потенциалу присваивается знак, одинаковый со знаком его заряда по отношению к нормальному водородному электроду.
Слева от водорода будут располагаться металлы, имеющие отрицательный электродный потенциал, а справа от водорода – имеющие положительный. Отрицательный электродный потенциал будет у тех электродов, которые заряжаются отрицательно, а ионы металла переходят с электрода в раствор. Положительный потенциал будет у тех электродов, которые заряжаются положительно, а ионы металла переходят из раствора на электрод.
Вернёмся к нашему примеру и замкнём внешнюю электрическую цепь.
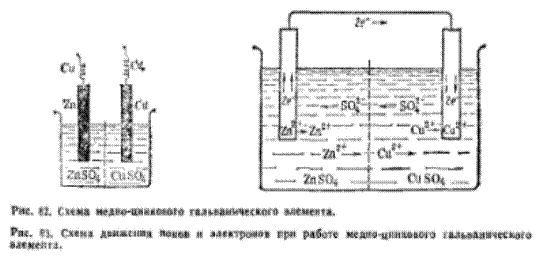
Устройство, в котором протекает направленная окислительно-восстановительная реакция, за счет которой выделяется электрическая энергия, а окислитель и восстановитель пространственно разделены, называется гальваническим элементом. Переход электронов от восстановителя к окислителю происходит по внешней цепи.
Электрод, на котором идет процесс восстановления, называется катодом, и на нём протекает катодный процесс:
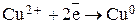
Электрод, на котором идет процесс окисления, называется анодом:
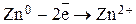
Электролит – раствор кислоты, щелочи или соли, содержащий ионы (катионы и анионы), проводящие в растворенном или расплавленном состоянии электрический ток.
Электролизом называется разложение электролита (в растворе или расплаве) при прохождении через него электрического тока, связанное с потерей или присоединением электронов ионами или молекулами растворенных веществ. При этом на катоде в результате присоединения электронов образуются продукты восстановления, а на аноде, в результате потери электронов – продукты окисления.
Все эти стадии сопряжены между собой и протекают с одной и той же скоростью. Поэтому скорость реакции, протекающей в гальваническом элементе, пропорциональна количеству электричества, перенесенного в цепи в единицу времени, т.е. силе тока в цепи.
Пара 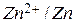 имеет отрицательный электродный потенциал -0,76 В и стоит левее водорода, пара
имеет отрицательный электродный потенциал -0,76 В и стоит левее водорода, пара 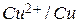 имеет положительный электродный потенциал +0,34 В и в электрохимическом ряду стоит правее водорода. Таким образом, в паре цинк-медь цинк оказывается более активным металлом, поэтому он отдает электроны, а медь их принимает.
имеет положительный электродный потенциал +0,34 В и в электрохимическом ряду стоит правее водорода. Таким образом, в паре цинк-медь цинк оказывается более активным металлом, поэтому он отдает электроны, а медь их принимает.
При условии, что цинковая пластина отдает электроны получает развитие процесс 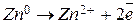 , при котором ионы цинка переходят в раствор, т.е. цинковая пластина начинает растворяться. В результате на этом электроде протекает процесс окисления, а сам электрод заряжается отрицательно.
, при котором ионы цинка переходят в раствор, т.е. цинковая пластина начинает растворяться. В результате на этом электроде протекает процесс окисления, а сам электрод заряжается отрицательно.
Электроны, поступающие от цинковой пластины на медный электрод, приводят к протеканию реакции восстановления: 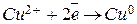 . В результате медь из раствора начинает осаждаться на электроде, а сам электрод заряжается положительно.
. В результате медь из раствора начинает осаждаться на электроде, а сам электрод заряжается положительно.
Суммарная реакция этого процесса может быть представлена следующим образом: 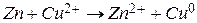 .
.
По мере протекания указанной реакции у медного электрода скапливается избыток ионов 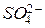 , а у цинкового – ощущается их недостаток. Поэтому избыточные ионы
, а у цинкового – ощущается их недостаток. Поэтому избыточные ионы 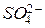 начинают через керамическую полунепроницаемую перегородку перемещаться от + к -, восстанавливая тем самым электронейтральность растворов в обоих отделениях гальванического элемента. Цепь замыкается.
начинают через керамическую полунепроницаемую перегородку перемещаться от + к -, восстанавливая тем самым электронейтральность растворов в обоих отделениях гальванического элемента. Цепь замыкается.
Схематически медно-цинковый элемент может быть представлен следующим образом:
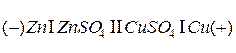
Слева принято изображать отрицательный электрод, справа – положительный. Вертикальные черточки соответствуют границам раздела фаз, на каждой из которых существует скачок потенциала. Одинарная черточка соответствует границе электрод-электролит, а двойная – границе двух электролитов. Таким образом, гальваническая цепь – это последовательная совокупность всех скачков потенциала на различных поверхностях раздела, отвечающих данному гальваническому элементу. Максимальная разность потенциалов, отвечающая обратимым условиям работы гальванического элемента, называется электродвижущей силой элемента (ЭДС) и обозначается буквой 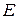 .
.
В гальваническом элементе протекает обратимая реакция: 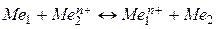 , которая может быть разбита на две следующие полуреакции:
, которая может быть разбита на две следующие полуреакции:
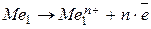 - реакция окисления с электродным потенциалом
- реакция окисления с электродным потенциалом 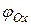
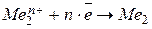 - реакция восстановления с электродным потенциалом
- реакция восстановления с электродным потенциалом 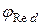 .
.
Соответственно ЭДС элемента может быть выражена следующим уравнением
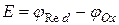
Работа, производимая гальваническим элементом, определяется по формуле:
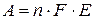
где 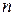 - число электронов, переносимых в результате процесса,
- число электронов, переносимых в результате процесса,
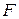 - постоянная Фарадея, численно равная 9.65×104,
- постоянная Фарадея, численно равная 9.65×104,
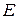 - ЭДС гальванического элемента, измеряемая в вольтах.
- ЭДС гальванического элемента, измеряемая в вольтах.
Таким образом, изменение свободной энергии Гиббса в результате работы, произведенной гальваническим элементом при температуре 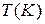 , находится по формуле:
, находится по формуле:
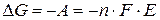
Изменение энтропии определяется по формуле 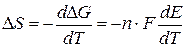
Изменение энтальпии находится по формуле
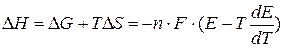
Если 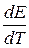 <0, то процесс носит экзотермический характер и ЭДС с ростом температуры уменьшается.
<0, то процесс носит экзотермический характер и ЭДС с ростом температуры уменьшается.
Если 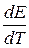 >0, то протекает эндотермический процесс, и ЭДС растет с ростом температуры.
>0, то протекает эндотермический процесс, и ЭДС растет с ростом температуры.
Если 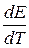 =0, то ЭДС не зависит от температуры (адиабатический процесс).
=0, то ЭДС не зависит от температуры (адиабатический процесс).
Перейдем к рассмотрению влияния природы и концентрации электролита на ЭДС и стандартный потенциал гальванического элемента.
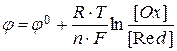
В этом случае 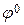 - характеризует влияние природы электролита, а второе слагаемое суммы – влияние его концентрации. Выражение для ЭДС соответственно принимает следующий вид:
- характеризует влияние природы электролита, а второе слагаемое суммы – влияние его концентрации. Выражение для ЭДС соответственно принимает следующий вид:
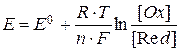
и является одной из форм записи уравнения Нернста.
В настоящее время различают три разновидности химических электродов: первого, второго и третьего рода.
К электродам первого рода относятся металлы, погруженные в растворы своих хорошо растворимых солей: 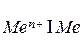 . В этом случае электродный потенциал определяется по формуле
. В этом случае электродный потенциал определяется по формуле 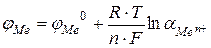 , где
, где 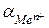 - активность ионов металла в растворе. В этом случае он не зависит от активности анионов, содержащихся в растворе, и является обратимым относительно катиона.
- активность ионов металла в растворе. В этом случае он не зависит от активности анионов, содержащихся в растворе, и является обратимым относительно катиона.
К электродам первого рода часто относят амальгамные электроды, отличающиеся от вышеприведенных тем, что вместо чистого металла используется раствор данного металла в ртути (амальгама), находящийся в контакте с раствором, содержащим ионы этого металла. Примером может служить кадмиевый амальгамный электрод 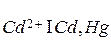 , в котором протекает реакция
, в котором протекает реакция 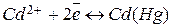 . Потенциал такого электрода зависит как от активности катионов кадмия, так и от активности металлического кадмия в амальгаме:
. Потенциал такого электрода зависит как от активности катионов кадмия, так и от активности металлического кадмия в амальгаме: 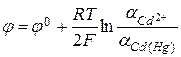
К электродам первого рода относят также газовые электроды, устройство которых было рассмотрено на примере водородного электрода, когда в лекции шла речь об электрохимическом ряде напряжений металлов. Кроме водородного электрода известны также кислородный и хлорный электроды.
Водородному электроду 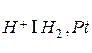 отвечает реакция
отвечает реакция 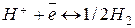 , а электродный потенциал выражается формулой
, а электродный потенциал выражается формулой 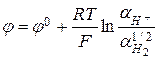 . Учитывая, что
. Учитывая, что 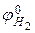 =0, а при стандартных условиях
=0, а при стандартных условиях 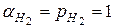 , выражение принимает вид:
, выражение принимает вид: 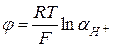 .
.
На хлорном электроде протекает реакция 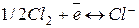 , для которой
, для которой 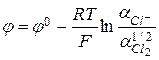 , а при
, а при 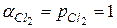 , соответственно,
, соответственно, 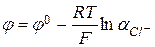 . Потенциал хлорного электрода определяется активностью анионов.
. Потенциал хлорного электрода определяется активностью анионов.
Процессы, протекающие на кислородном электроде, аналогичны процессам, протекающим на хлорном.
Электроды второго рода состоят из металла, покрытого слоем труднорастворимого соединения этого металла и опущенного в раствор соли с таким же анионом. Примером является хлорсеребряный электрод 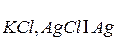 , представляющий собой пластинку серебра, покрытую осадком хлорида серебра и опущенную в раствор хлорида калия.
, представляющий собой пластинку серебра, покрытую осадком хлорида серебра и опущенную в раствор хлорида калия.
В этом случае на электроде будут протекать следующие процессы:
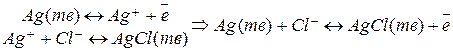
В этом случае значение электродного потенциала определяется ионами хлора: 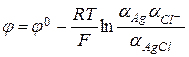 . Учитывая, что активности чистых веществ постоянны, получаем:
. Учитывая, что активности чистых веществ постоянны, получаем: 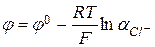 .
.
Другим электродом второго рода является каломельный электрод 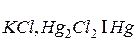 , состоящий из ртути, покрытой каломелью и помещенный в раствор хлорида калия.
, состоящий из ртути, покрытой каломелью и помещенный в раствор хлорида калия.
Электроды второго рода обладают высокой стабильностью потенциалов и применяются в качестве электродов сравнения.
Электроды третьего рода (редокс-электроды) характеризуются тем, что все участники электродной реакции находятся в растворе. Применяемый в них инертный металл (например, платина) служит лишь резервуаром электронов и непосредственного участия в процессе не принимает. Например, электродом третьего рода является электрод 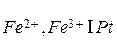 , состоящий из платиновой пластинки, опущенной в раствор, содержащий ионы железа различной валентности. На данном электроде протекает реакция
, состоящий из платиновой пластинки, опущенной в раствор, содержащий ионы железа различной валентности. На данном электроде протекает реакция 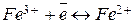 , а его потенциал равен
, а его потенциал равен 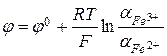 .
.
Как и любой процесс, электролиз протекает по своим законам.
С качественной точки зрения могут быть перечислены следующие:
1. Электролиз представляет собой окислительно-восстановительный процесс: на катоде (-) идет процесс восстановления, на аноде (+) – процесс окисления. Различают первичные (электронные) процессы и вторичные (химические) процессы. Например, восстановление ионов водорода с последующим образованием молекулы:
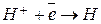
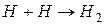
2. Порядок разряда ионов в водных растворах носит строго определенный характер. На катоде в первую очередь восстанавливается тот катион, потенциал которого более положителен. Таким образом, мы возвращаемся к электрохимическому ряду напряжений металлов. Если металл стоит в ряду напряжений правее водорода, то он будет восстанавливаться на катоде по реакции: 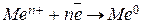 . Если металл находится левее водорода в промежутке от
. Если металл находится левее водорода в промежутке от 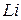 до
до 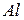 (включительно), то на катоде будет восстанавливаться катион водорода. В кислой среде реакция имеет вид:
(включительно), то на катоде будет восстанавливаться катион водорода. В кислой среде реакция имеет вид: 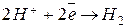 . В нейтральной или щелочной:
. В нейтральной или щелочной: 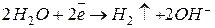 . Если металл находится в ряду напряжений между алюминием и водородом, то на катоде будут одновременно протекать два процесса:
. Если металл находится в ряду напряжений между алюминием и водородом, то на катоде будут одновременно протекать два процесса: 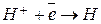 и
и 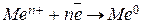 .
.
Для того, чтобы говорить об электродных процессах, протекающих на аноде, в первую очередь надо отметить тот факт, что аноды бывают двух видов: растворимые и нерастворимые. Нерастворимые (инертные) аноды могут быть изготовлены из графита, угля, благородных металлов, реже – свинца. Если в растворе в этом случае присутствуют анионы бескислородных кислот, то протекает реакция их окисления: 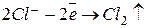 . Если же подобные кислоты отсутствуют, то протекает окисление ионов гидроксида с последующим выделением кислорода:
. Если же подобные кислоты отсутствуют, то протекает окисление ионов гидроксида с последующим выделением кислорода: 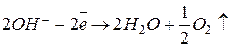 . Если анод является растворимым (металлическим), то на нем наблюдается реакция:
. Если анод является растворимым (металлическим), то на нем наблюдается реакция: 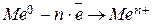 .
.
К количественным законам электролиза относятся законы Фарадея, выведенные им в 30-х годах XIX века.
1-ый закон Фарадея. Масса образующегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества.
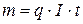 , где
, где
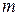 - масса образовавшегося вещества (г);
- масса образовавшегося вещества (г); 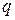 - электрохимический эквивалент (г/А×ч);
- электрохимический эквивалент (г/А×ч); 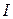 - сила тока (А);
- сила тока (А); 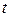 - время электролиза (ч). Эта пропорциональность возникает потому, что количество вещества, выделяющееся на электроде всегда пропорционально числу прошедших по цепи электронов, т.е. количеству электричества.
- время электролиза (ч). Эта пропорциональность возникает потому, что количество вещества, выделяющееся на электроде всегда пропорционально числу прошедших по цепи электронов, т.е. количеству электричества.
Это – то, что должно быть в теории. При протекании же реальных процессов количество выделившегося вещества на электроде обычно меньше теоретически возможного. Его доля, которая называется выход по току, рассчитывается по следующей формуле: 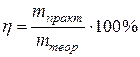 . Т.е. представляет собой массовую долю вещества (вспомните тему СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА).
. Т.е. представляет собой массовую долю вещества (вспомните тему СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА).
2-ой закон Фарадея. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств веществ.
Измерениями установлено, что количество электричества, обусловливающее электрохимическое превращение одного эквивалента вещества, равно 96 500 кулонам. Эта величина имеет размерность Кл/ммоль, обозначается буквой 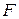 и называется постоянной Фарадея.
и называется постоянной Фарадея.
Поляризация при электролизе складывается из поляризации (химическая и концентрационная) и перенапряжения.
Химическая поляризация возникает при использовании инертных электродов (платина, углерод, керамика). Они хорошо адсорбируют газы
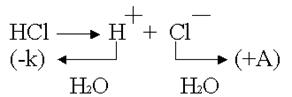
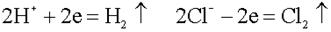
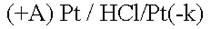
Платина-анод насыщается хлором, платина-катод – водородом, хлор может только восстанавливаться, водород – только окисляться.
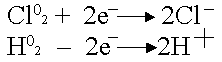
В электролизере образуется гальванический элемент:

ЭДС возникшего гальванического элемента направлена против внешнего напряжения и ослабляет его. Данный вид поляризации называется химическим, поскольку электроды как-бы меняют свою химическую природу. Поляризация приводит к перерасходу электроэнергии. Для устранения химической поляризации в раствор добавляют вещества, которые очищают электроды от поглощенных газов (деполяризаторы).
Концентрационная поляризация возможна при активном аноде, например, серебряном.
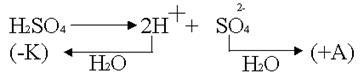
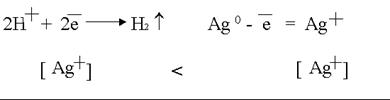
За счет процесса диффузии ионы серебра начинают перемещаться от анода к катоду, где они будут восстанавливаться как более сильные окислители. Устраняется перемешиванием раствора.
Величина смещения потенциала электрода), необходимая для протекания данного процесса с определенной скоростью, называется перенапряжением данного электродного процесса.
Катодное перенапряжение ∆Е = ЕК - ЕOx/Red
Анодное перенапряжение: ∆Е = ЕА - ЕOx/Red
Дата добавления: 2018-03-01; просмотров: 3570;
