Условия образования и растворения осадка
При любом произвольном соотношении компонентов «твердый осадок - раствор» система будет стремиться к состоянию равновесия.
Этот процесс можно описать при помощи изотермы Вант-Гоффа:
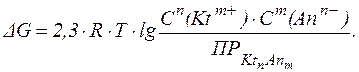
В ненасыщенном или пересыщенном растворе величина 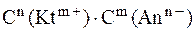 называется произведение концентраций ионов и обозначается
называется произведение концентраций ионов и обозначается 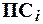 .
.
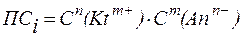
Из уравнения изотермы Вант-Гоффа видно, что если 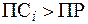 (пересыщенный раствор), то DG > 0 и, следовательно, процесс самопроизвольно протекает в обратном направлении, т.е. в сторону образования твердой фазы.
(пересыщенный раствор), то DG > 0 и, следовательно, процесс самопроизвольно протекает в обратном направлении, т.е. в сторону образования твердой фазы.
В другом случае, если 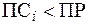 (ненасыщенный раствор), то DG < 0 и процесс самопроизвольно протекает в прямом направлении, т.е. в сторону растворения осадка.
(ненасыщенный раствор), то DG < 0 и процесс самопроизвольно протекает в прямом направлении, т.е. в сторону растворения осадка.
Таким образом, зная концентрации ионов в растворе, можно прогнозировать направление смещения гетерогенного равновесия:
Отсюда следует, что для растворения осадка достаточно уменьшить концентрацию одного из ионов. Этого можно достичь, например, добавляя реагент, связывающий ион малорастворимого электролита в растворимое малодиссоциирующее соединение или газообразное вещество.
Дата добавления: 2017-12-05; просмотров: 634;
