ГЕТЕРОГЕННЫЕ РАВНОВЕСИЯ
Термодинамическую систему, все свойства которой во всех точках одинаковы, либо плавно изменяются от точки к точке, называют гомогенной.
Гомогенная система может состоять из нескольких веществ, называемых компонентами. Гомогенными системами являются, например, водные растворы хорошо растворимых солей (NaCl, KCl, Ca(NO3)2) и органических соединений (этилового спирта, уксусной кислоты).
Термодинамическую систему, свойства которой от точки к точке изменяются скачкообразно, называют гетерогенной. Такая система состоит из нескольких гомогенных частей. Гомогенную часть гетеро-генной системы называют фазой. Каждая фаза характеризуется массой, геометрическими размерами, и, главное, наличием границы раздела, отделяющей ее от других фаз.
Гетерогенными системами являются, например, жидкость-пар, твердый осадок-насыщенный раствор, твердое тело-газ.
Равновесия, которые устанавливаются на границе раздела фаз, называют гетерогенными равновесиями.
Произведение растворимости (ПР)
Рассмотрим процессы, возникающие при взаимодействии твердого вещества KtnAnm ионного типа с водой. Под действием растворителя ионы Ktm+ и Аnn- будут переходить в жидкую фазу и одновременно, за счет электростатического притяжения, часть перешедших в раствор ионов вновь будет осаждаться на твердой фазе. Спустя некоторое время в системе установится равновесие, кинетическим условием которого является равенство скоростей процессов растворения и осаждения, а термодинамическим - постоянство свободной энергии Гиббса (DG = 0).
Раствор, находящийся в равновесии с твердой фазой, называют насыщенным.
В водных растворах растворенная часть вещества-электролита, в большинстве случаев, полностью диссоциирует на ионы. Поэтому в системе твердое вещество – насыщенный раствор устанавливается равновесие между осадком и ионами, образовавшимися при диссоциации растворенной части вещества:
|
|
Применив к этому равновесию закон действующих масс, получим выражение для константы равновесия:
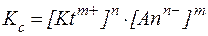 .
.
Таким образом:
В насыщенном растворе малорастворимого сильного электролита при данной температуре произведение молярных концентраций его ионов, возведенных в степени их стехиометрических коэффициентов, есть величина постоянная и называется константой или произведением растворимости.
Произведение растворимости ПР (или 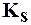 ) количественно харак-теризует растворимость данного вещества при данной температуре:
) количественно харак-теризует растворимость данного вещества при данной температуре:
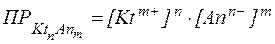
Величина ПР зависит от природы электролита, растворителя и температуры. С ростом температуры ПР обычно увеличивается, так как при нагревании раствора для большинства твердых веществ характерно увеличение растворимости.
Величина ПР малорастворимого сильного электролита связана с его растворимостью, которую в данном случае выражают как молярную концентрацию электролита в насыщенном растворе:
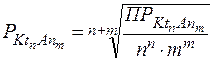
n, m - стехиометрические коэффициенты т.е. число катионов и анионов.
В некоторых случаях растворимость выражают в г/л. Пересчет можно выполнить при помощи соотношения:
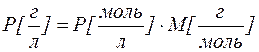
Дата добавления: 2017-12-05; просмотров: 1721;
