Смещение гетерогенного равновесия
1. Влияние одноименного иона.
Из постоянства величины ПР не следует постоянство концентраций отдельных ионов и концентрацию каждого из них можно варьировать в определенных пределах.
При добавлении одноименного иона, например Аnn-, в системе установится равновесие, которое будет по-прежнему характеризоваться той же величиной 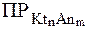 , но другими равновесными концентрациями ионов Ktm+ и Аnn-.
, но другими равновесными концентрациями ионов Ktm+ и Аnn-.
BaSO4 ⇄ Ba2+ + SO42-

смещение равновесия
Na2SO4 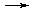 2Na+ + SO42-
2Na+ + SO42-
Видно, что введение в систему одноименного иона смещает равновесие в направлении образования осадка. Таким образом, при осаждении сульфатов в виде BaSO4 добавление Na2SO4 понижает растворимость сульфата бария и способствует более полному выведению ионов Ba2+ из раствора.
2. Влияние посторонних ионов.
Введение в насыщенный раствор вещества-электролита, не содержащего одноименных ионов с осадком, напротив, повышает растворимость соединения (солевой эффект). Причиной солевого эффекта является усиление межионных взаимодействий, способст-вующих переходу ионов вещества из кристаллической решетки (твердой фазы) в раствор.
Так, растворимость сульфата бария в растворе хлорида натрия - сильного электролита, не образующего одноименных ионов с осадком - выше, чем в чистой воде.
3. Влияние кислотности среды.
В некоторых случаях малорастворимые соли слабых кислот растворяются в более сильных кислотах. Добавление сильной кислоты повышает концентрацию ионов H+, которые с анионами соли образуют малодиссоциированную слабую кислоту. При этом концентрация аниона понижается, и гетерогенное равновесие смещается в сторону растворения осадка.
Так, малорастворимый в воде карбонат бария легко растворяется при добавлении соляной кислоты, поскольку из-за протекания реакции:
2H+ + CO32- ⇄ H2CO3 ⇄ СО2 + H2O
в растворе снижается концентрация ионов СО32- и равновесие:
BaCO3 ⇄ Ba2+ + CO32-
| |||
| |||
смещается в сторону растворения осадка.
Растворимость солей, образованных анионами слабых одноосновных кислот, можно вычислить по формуле:
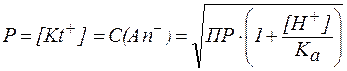 .
.
Для малорастворимых солей, образованных слабыми двухосновными кислотами, справедливо уравнение:
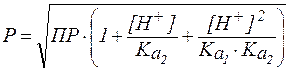 .
.
Из этих уравнений можно сделать следующие выводы:
Чем больше произведение растворимости соли и чем меньше константа диссоциации образующейся слабой кислоты, тем больше растворяющее действие прибавляемой кислоты на осадок.
Чем слабее кислота, соответствующая аниону соли (т.е. чем меньше 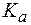 ), тем меньшее подкисление раствора требуется для увеличения растворимости соли.
), тем меньшее подкисление раствора требуется для увеличения растворимости соли.
Дата добавления: 2017-12-05; просмотров: 720;
