Электрофильное присоединение (АЕ) несимметричных полярных
реагентов к алкеном с разной степенью замещенности у атомов углерода при двойной связи протекает по правилу Марковникова: катионная часть реагента Хd+ (обычно Н+) присоединяется к более гидрогенизированному атому углерода, а анионная часть Yd-- ко второму, менее гидрогенизированному ненасыщенному С-атому:
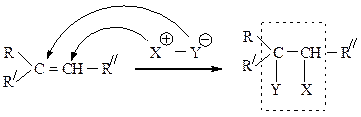
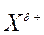 Н Н Н Н С1
Н Н Н Н С1
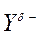 Br C1 ОН OSO3H ОН
Br C1 ОН OSO3H ОН
а) Гидрогалогенирование.
Гидрогалогенирование алкенов чаще всего проводят по ионному (электрофильному) механизму. Схема протекания реакции АЕ на примере гидробромирования бутена-1 следующая:
С2H5–CH=CH2 + HBr ─→С2H5–CHBr–CH3
2-бромбутан
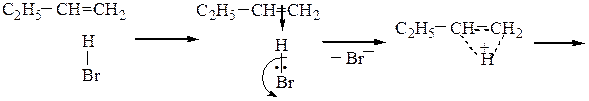
π-комплекс гидроксоний-катион
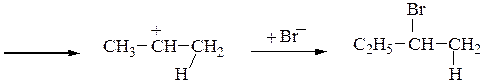
вторичный карбкатион устойчивей,
чем первичный СH3(CH2)2CH2+
Таким образом, правило Марковникова объясняется устойчивостью промежуточно образующихся в результате присоединения протона карбкатионов, которая уменьшается в ряду: третичный, вторичный, первичный.
В присутствии пероксидов гидробромирование бутена-2 протекает по механизму радикального присоединения (AR) против правила Марковникова
(эффект Хараша):
Н2О2
С2H5–CH=CH2 + HBr ¾¾® С2H5–CН2–CH2Br
1-бромбутан
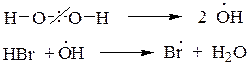
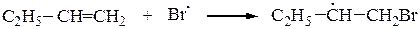
вторичный радикал более устойчив,
чем первичный радикал С2H5CHBrCH2.

По механизму AR против правила Марковникова присоединяется только HBr, остальные галогеноводороды не реагируют по пероксидному эффекту:HCl имеет слишком полярную связь и не расщепляется гомолитически, а HI - сильный восстановитель, разрушающий пероксиды.
Правило Марковникова также нарушается в случаях, когда электронная плотность двойной связи сильно деформирована за счет соседства с электроноакцепторной группой ( –СF3 , –CN, –COOH, –SO3H, –NO2 и др.). Так, при гидробромировании 3,3,3-трифторпропена-1, благодаря сильному электроноакцепторному влиянию трифторметильной группы образующийся первичный карбкатион CF3СН2СН2+ будет более устойчивым, чем вторичный CF3СH+CH3. Реакционная способность двойной связи будет ослаблена, а продукт не будет соответствовать правилу Марковникова:
CF3СН=СН2 + HBr ¾¾® CF3СН2–СН2Br
б) Гидратация (присоединение воды). Протекает по аналогичной схеме электрофильного присоединения (АЕ). В качестве катализаторов применяют H2SO4 , H3PO4 или кислоты Льюиса.
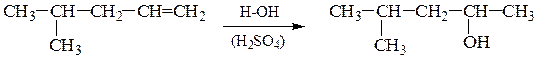
Поскольку вода присоединяется по правилу Марковникова, то всегда продуктом реакции будут вторичные или третичные спирты (кроме случая гидратации этилена: CH2=CH2 + H2O ¾® CH3–CH2–OH этанол).
Для получения первичных спиртов из алкенов используют метод гидроборирования-окисления, который служит примером присоединения воды по двойной связи, но в отличие от классической гидратации, присоединение к несимметричным алкенам происходит против правила Марковникова:
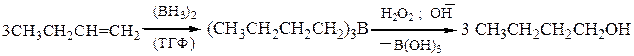
Кроме того, гидроборирование-окисление осуществляется как цис- присоединение. Исходный диборан получают по реакции:
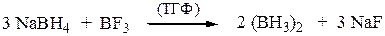
в) Сульфатирование (сульфатация, О-сульфирование). Серная кислота присоединяется по двойной связи алкенов согласно правилу Марковникова, образуя моно- и диэфиры серной кислоты:
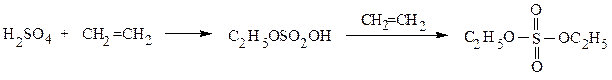
этилсерная кислота диэтилсульфат
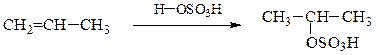
кислый сульфат изопропилового
спирта (изопропилсерная кислота)
г)Гипохлорирование – взаимодействие алкенов с хлорноватистой кислотой HOCl, приводящее к хлоргидринам. Реакция также подчиняется правилу Марковникова: электрофильный хлор направляется к более гидрогенизированному атому углерода. Часто для получения хлоргидринов из алкенов в качестве реагентов используют хлор и воду.
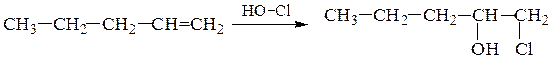
1-хлорпентанол-2
4. Димеризация изобутилена протекает в присутствии H2SO4 при 80 0С и дает смесь 2,4,4-триметилпентена-1 и 2,4,4-триметилпентена-2:
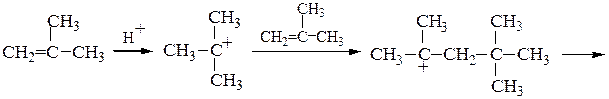
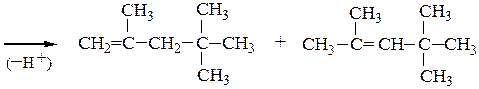
5. Алкилирование изобутилена изобутаном. Первые две стадии механизма реакции изобутилена с изобутаном совпадают со случаем димеризации изобутилена; образовавшийся катион вырывает атом водорода с его парой электронов из молекулы алкана, что приводит к 2,2,4-триметилпентану, а новый карбониевый ион продолжает цепь:
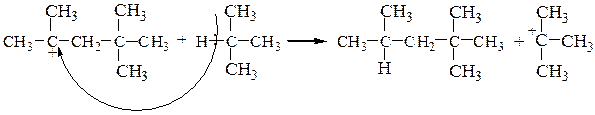
Дата добавления: 2017-09-19; просмотров: 6045;
