ОСОБЕННОСТИ ХИМИИ ЦИКЛОПРОПАНА
Циклоалканы СnН2n проявляют свойства обычных алканов (см. выше). Их циклический углеродный скелет имеет форму правильного многоугольника, но не является плоским. Для молекулы циклобутана характерно быстрое превращение двух эквивалентных неплоских «сложенных» конформаций (а). Циклопентан имеет неплоскую конфигурацию за счет опускания одного из углов, которое быстро «пробегает» по всему циклу в результате вращения С–С связей (б). Циклогексан также имеет неплоские конформации, свободные от углового напряжения (в) (см. рис. 4).
(а) 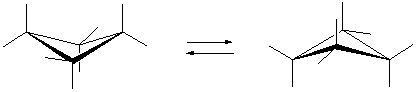
(б) 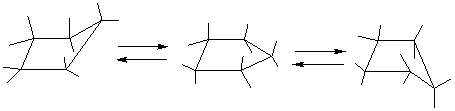

(в) конформация кресла конформация ванны твист-конформация
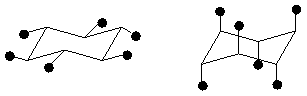
экваториальные связи аксиальные связи
Рис. 4.Неплоские конформации циклобутана (а), циклопентана (б) и циклогексана (в).
В энергетическом плане у циклогексана наиболее выгодна конфигурация кресла, поскольку в ней все С–Н связи находятся в эаторможенных конформациях, наименее выгодна форма ванны, где имеется две пары связей С–Н, находящиеся в заслоненных конформациях, что приводит к отталкиванию электронных оболочек атомов водорода, находящихся рядом друг с другом.
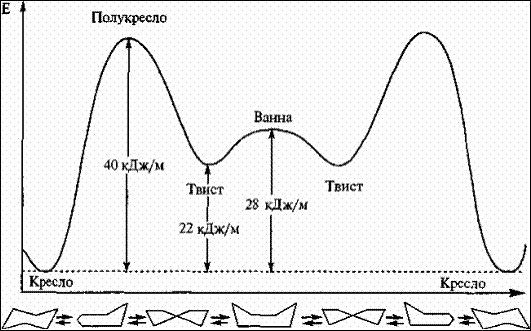
Рис. 5 Конформации циклогексана и их относительная энергия
В отличие от них, циклопропан и его производные содержат плоский трех-членный цикл, у которого внутренний угол между С–С связями намного меньше (600), чем нормальный (109028/). Из-за этого молекула циклопропана очень напряжена и поэтому ей характерны реакции присоединения реагентов за счет разрыва цикла:
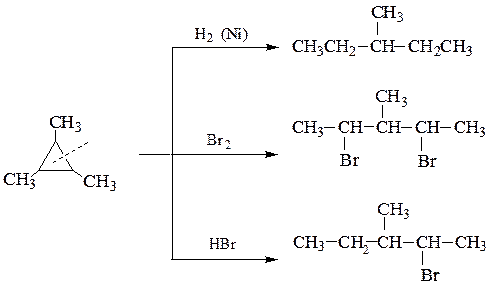
Контрольные вопросы к главе 1 «Предельные углеводороды»
№ 1.Вазелин - смесь алканов состава С12Н26 - С25Н52; применяется в фармацевтической промышленности в качестве основы для приготовления мазей. Сколько атомов углерода содержится в алкане, входящем в состав вазелина и имеющем в молекуле 36 атомов водорода?
№ 2.Какой газообразный алкан имеет при н.у. плотность 1,339 г/л ?
№ 3. (а) При сгорании 14,4 г алкана образовалось 22,4 л СО2. Какой объем кислорода (л, н.у.) потребуется? (б)Для сжигания 5 л нормального алкана потребовалось 40 л кислорода (н.у.). Установите, какой углеводород сожгли. (в)При сгорании 11,2 л смеси метана и этана получено 13,44 л. (н.у.) СО2. Рассчитайте объемную долю (%) метана в исходной смеси. (г) Газ, образовавшийся при полном сгорании 0,02 моль алкана, пропустили через избыток известковой воды; при этом выпало 12 г осадка. Определите молекулярную формулу алкана.
№ 4.(а)Выведитемолекулярную формулу алкана, если при хлорировании 1,28 г его на свету было получено 6,84 г дихлорпроизводного. (б) Монобромид алкана содержит 65 % брома (по массе). Какова молекулярная формула вещества? (в) Определите молекулярную формулу бромпроизводного пропана, в 4,04 г которого содержится 3,2 г брома.
№ 5. Приведите механизм хлорирования 2,3-диметилбутана на свету.
№ 6. Приведите механизм нитрования 2-метилбутана в газовой фазе. При нитровании алканов по Коновалову наряду с нитроалканами образуется также некоторое количество изомерных им алкилнитритов. Как это можно объяснить?
№ 7.Сколько всевозможных алканов можно получить из смеси изомерных соединений состава С4H9Cl по реакции Вюрца? Почему выход циклоалканов по реакции Вюрца выше при проведении ее в разбавленных растворах, чем в концентрированных?
№ 8. Предложите схему синтеза дициклопентила из циклопентана. и неорганических реактивов.
№ 9.Три изомерных алкана С5Н12 (А, Б и В) при монохлорировании образуют соответственно одно, три и четыре изомерных продукта состава С5H11Сl. Напишите структурные формулы углеводородов А, Б и В. Назовите их по номенклатуре IUPAC.
№ 10.Определите строение углеводородов состава С8Н18, если: (a) при хлорировании образуется только одно монохлорпроизводное; (б) при нитровании образуется третичное нитропроизводное, и может быть синтезировано по реакции Вюрца из первичного алкилгалогенида без побочных продуктов; (в) при бромировании дает третичное монобром-производное, и может быть получено в качестве единственного алкана по реакции Вюрца из вторичного алкилгалогенида.
АЛКЕНЫ (ОЛЕФИНЫ)
Определение.Ненасыщенные углеводороды, содержащие одну двойную связь и образующие гомологический ряд общей формулы СnH2n .
Номенклатура.
Рациональная номенклатура используется для наименования простых соединений. В основе рационального названия алкенов обычно используют тривиальное название простейшего алкена – этилена и рассматривают как замещенный этилен. Положения радикалов указывают, обозначая С-атомы остатка этилена как «a» и «b». Расположение радикалов у двух С-атомов замещенного этилена может быть симметричным (оба радикала связаны с разными атомами углерода) и несимметричным (оба радикала связаны с одним атомом углерода).
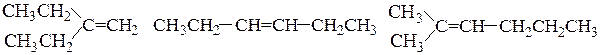
несимм.-диэтилэтилен симм.-диэтилэтилен a,a-диметил-b-пропилэтилен
(a,a-диэтилэтилен) (a,b-диэтилэтилен)
По номенклатуре IUPAC название алкена происходит от названия соответствующего алкана заменой суффикса «-ан» на «-ен». Положение двойной связи обозначают цифрой, указывающей наименьший номер атома углерода главной цепи, при котором она находится. Двойная связь имеет приоритет перед алкильными группами, галогенами, нитро- и аминогруппами. Аналогично образуют названия циклоалкенов.
СH3 СH3 СH3
1 2 3 | 4 5 6 | 7 | 8
СH3–CH2–C=CH–CH–CH–CH–CH3
3,6,7-триметилоктен-3
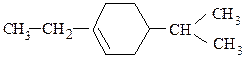
1-этил-4-изопропилциклогексен-1
Изомерия.Для алкенов характерны следующие виды изомерии:
1. Начиная с бутилена алкены обладают двумя видами структурной изомерии
а) изомерией углеродного скелета:
CH3
|
CH2=CH–CH2–CH3 CH2=C–CH3
бутен-1 2-метилпропен-1
б) изомерией положения двойной связи:
CH2=CH–CH2–CH3 CH3–CH=CH–CH3
бутен-1 бутен-2
2. Наличие двойной связи между атомами углерода, находящимися в | |
sp2-гибридизации делает фрагмент –С=С– плоским, вокруг двойной связи нет свободного вращения, отчего у алкенов возможен один из видов пространст-венной изомерии, а именно геометрическая или цис-транс-изомерия.
Цис-изомеры– геометрические изомеры, в которых заместители, образующие главную углеродную цепь в молекуле вещества, расположены по одну сторону относительно двойной связи.
Транс-изомеры– геометрические изомеры, в которых заместители, образующие главную углеродную цепь в молекуле вещества, расположены по разные стороны относительно двойной связи.
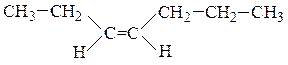
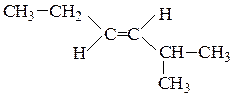
цис-гептен-3 транс-2-метилгексен-3
Нередко цис,транс-номенклатура не позволяет однозначно назвать
геометрические изомеры алкенов. Универсальной же является рекомендуемая в настоящее время правилами IUPAC E,Z-номенклатура.
Старшинство групп определяется атомным номером элемента, атом которого связан с С-атомом при двойной связи, а при одном и том же элементе атомными номерами следующих элементов вдоль цепи заместителя ( I > Br > Cl > F > OCH3 > OH > NH2 > COOH > CHO > CH2OH > CN > C6H5 > CºCH > CH=CH2 > CH2CH3 > CH3 > H). Если старшая группа (или атом) при одном винильном атоме углерода находится по одну сторону со старшей группой (или атомом) у другого винильного атома углерода, то это Z-изомер (старшие группы -Вr и -OCH3), если по разные стороны от плоскости двойной связи, то это Е-изомер. В случае алкенов цис-изомеры являются Z-изомерами, а транс-изомеры - Е-изомерами, так как соответствуют расположению главной цепи по отношению к двойной связи.

Z-изомер Е-изомер
Строение.Атом углерода в этиленовых углеводородах находится в sp2-гибридизиро-ванном состоянии. Три гибридные sp2—орбитали каждого атома углерода (состоящие из одной s- и двух р-орбиталей) участвуют в образовании трех σ-связей: одной с соседним атомом углерода и двух с атомами водорода. Все σ-связи расположены в одной плоскости под углом 1200 по отношению друг к другу. При этом у каждого атома углерода остается по одному свободному негибридному р-электрону. Негибридизованные р-орбитали перекрываются в плоскости, перпендикулярной плоскости σ-связи. Связь, образованную за счет такого перекрывания, называют π-связью. Следовательно,
двойная связь между атомами углерода образована и s-, и p-связью. Расстояние между углеродными атомами, связанными двойной связью, равно 0,134 нм.
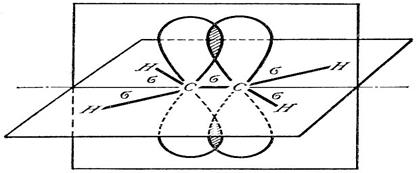
Рис. 6. σ- и p-связи в молекуле этилена
Наличие в молекуле алкенов двойной связи – отличительная особенность этой группы углеводородов и определяет их поведение в химических реакциях.
Физические свойства.Первые три члена гомологического ряда алкенов – газы, углеводороды от С4 до С16 – жидкости, высшие алкены – твердые вещества. Алкены нерастворимы в воде и в других полярных растворителях, но растворимы в углеводородах; жидкие алкены имеют неприятный запах, их плотность меньше единицы (см. Табл. 4)..
Способы получения.
1.Крекинг нефти (промышленный метод). Углеводородные цепи алканов разрываются гомолитически, и в результате последующего перераспределения водорода между образовавшимися радикалами получается смесь алканов и алкенов. Крекинг может быть термическим (600-750 0С) и каталитическим (алюмосиликаты, хлорид алюминия и др. при 350-500 0С). С целью повышения выхода алкенов также проводят дегидрирование насыщенных углеводородов.
Так, например, из бутана при катализе Cr2O3 при нагревании до 300 0C получают смесь бутена-1 и бутена-2.
Cr2O3; 300 0C
2 СH3–CH2–CH2–CH3 ¾¾¾¾¾® CH2=CH–CH2–CH3 + CH3–CH=CH–CH3
─ 2 Н2
2. Частичное гидрирование алкинов на катализаторе Ландлара:
специально приготовленном палладиевом катализаторе, «отравленным», например, оксидом свинца или ацетатом свинца и карбонатом кальция; реакция позволяет осуществить избирательное гидрирование алкинов до цис-алкенов:
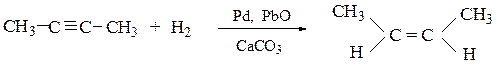
Из препаративных способов получения алкенов следует остановиться на следующих:
3. Отщепление двух атомов галогена (дегалогенирование) от соседних углеродных атомов под действием цинковой пыли:
Br–CH2–CH2–Br + Zn ¾¾¾® CH2=CH2 + ZnBr2
4. Дегидрогалогенирование галогенопроизводных углеводородов.Отщепление
Отщепление галогеноводорода от молекулы органического соединения протекает под действием сильного основания (водно-спиртового раствора гидроксида калия, алкоголятов щелочных металлов и др.) Образование двойной
Таблица 4 . Физические свойства алкенов и циклоалкенов.
| Название | Формула | Т пл. 0С | Т.кип. 0 С | ρ, г· см-3 |
| Этилен Пропен Бутен-1 Цис-бутен-2 Транс-бутен-2 Изобутилен Пентен-1 Цис-пентен-2 Транс-пентен-2 Гексен-1 Гептен-1 Октен-1 Нонен-1 Децен-1 Стирол 1,1-дифенилэтилен Аллен Бутадиен-1,3 1-фенилбутадиен-1,3 2-метилбутадиен-1,3 (изопрен) Пентадиен-1,3 (пиперилен) 3-метилбутен-1 2-метилбутен-2 2,3-диметилбутен-2 Циклопентен Циклопентадиен Циклогексен |
СН2=СН2
СН2=СН–СН3
СН2=СН–СН2–СН3
цис-СН3–СН=СН–СН3
транс-СН3–СН=СН–СН3
СН2=С(СН3)2
СН2=СН–(СН2)2–СН3
цис-СН3–СН=СН–СН2 СН3
транс-СН3–СН=СН–СН2СН3 СН2=СН–(СН2)3–СН3
СН2=СН–(СН2)4–СН3
СН2=СН–(СН2)5–СН3
СН2=СН–(СН2)6–СН3
СН2=СН–(СН2)7–СН3
СН2=СН–С6Н5
(С6Н5)2С=CH2
СН2=С=СН2
СH2=CH–CH=CH2
С6Н5– СH=CH–CH=CH2
СH2=C(СH3)–CH=CH2
СH2=CH–CH=CH–СН3
СH2=CH–CН(CH3)–СН3
СH3–C(СН3)=CH–CH3
СH3–C(СН3)=C(СH3)–CH3
| - 169 - 185 - 139 - 139 - 106 - 141 - 138 - 151 - 138 - 119 - 104 - 87 - 30,5 + 8,5 - 146 - 109 + 4,5 - 145 - - 135 - 123 - 74 - 135 - 85 - 103 | -102 - 48 - 6 - 7 + 30 + 37 + 36 + 63,5 + 93 + 122 + 146 + 171 + 146 + 277 - 32 - 4,4 +95 (10 мм рт. ст.) + 34 + 43 + 25 + 39 + 73 + 45 + 41.5 + 83 | 0,610 0,610 0,620 0,635 0,626 0,64 0,655 0,647 0,674 0,697 0,715 0,731 0,743 0,907 1,020 1,787 0,650 0,928 0,681 0,683 0,648 0,660 0,705 0,776 0,804 0,810 |
связи между атомами углерода протекает по правилу Зайцева, согласно которому водород отщепляется от соседнего наименее гидрогенизированного атома углерода; образующийся алкен наиболее замещен у двойных связей.
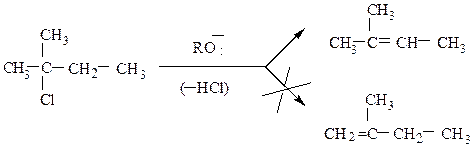
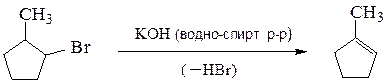
5. Внутримолекулярная дегидратация спиртов. На катализаторах кислотного типа (H2SO4 , H3PO4 , кислоты Льюиса – ZnCl2 и др.) спирты отщепляют молекулу воды по правилу Зайцева. Реакция протекает по схеме:
H2SO4
СH3–CH2–CH–CH3 ¾¾® СH3–CH=CH–CH3 + H2O
|
OH
+ H+ –H2O +
СH3–CH–CH–CH3 ¾® СH3–CH–CH–CH3 ¾¾® СH3–CH2–CH–CH3 ¾®
| | | | карбкатион
H OH H +O–H
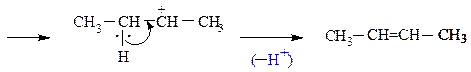
Дата добавления: 2017-09-19; просмотров: 2542;
