Ферменты. Строение и механизм действия
Ферменты по химической природе являются:
1) простыми белками – состоят только из аминокислот;
2) сложными белками – (апофермент + кофактор)
 металлы (Zn2+, Mg2+, Cu2+, K+, Na+, Fe2+, Fe3+ и др.)
металлы (Zn2+, Mg2+, Cu2+, K+, Na+, Fe2+, Fe3+ и др.)
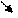 кофактор
кофактор
кофермент: витаминный (производные витаминов)
невитаминный (гем, УДФ-глюкоза, глутатион и др.)
Активный центр фермента - участок в молекуле фермента, к которому присоединяется субстрат (акцепторный участок) и который обеспечивает превращение субстрата в продукты реакции (каталитический центр). Активный центр ферментов - простых белков состоит из функциональных групп аминокислот (12-16 радикалов). В активный центр сложных ферментов входит также небелковая часть. Формирование активного центра происходит в момент возникновения третичной и четвертичной структуры белка и присоединения кофактора, если фермент является сложным белком.
Аллостерический центр фермента – другой участок в молекуле фермента, к которому могут присоединяться вещества-регуляторы (эффекторы), вследствие чего каталитическая активность фермента меняется.
Аллостерические эффекторы (модификаторы, модуляторы) - вещества, изменяющие активность фермента. К ним относятся метаболиты, ионы металлов, коферменты, лекарственные препараты и др. Положительные аллостерические эффекторы активируют фермент, отрицательные - ингибируют.
Изоферменты (изоэнзимы) – это группа ферментов, катализирующих одну химическую реакцию, но отличающихся по аминокислотному составу, сродству к субстрату, локализации в тканях. Биологическое значение наличия изоферментов: в определенных тканях различные условия для протекания реакций, например, в скелетных мышцах - анаэробные условия – активен ЛДГ5, в миокарде – аэробные условия – активен ЛДГ1. Таким образом, изоферменты выполняют своеобразную роль регуляторов метаболизма.
Полиферментные системы по своей организации делятся на:
1. Функциональные - ферменты не связаны друг с другом, объединены по функции, молекулы субстратов и ферментов перемещаются путем диффузии (ферменты гликолиза, синтеза триглицеридов, холестерина).
2. Структурно-функциональные - ферменты связаны с определенными клеточными структурами и объединены по функции (ферменты дыхательной цепи).
3. Смешанные - (ферменты цикла трикарбоновых кислот), часть ферментов связаны структурно-функционально, а часть функционально.
Механизм действия ферментов - современная теория механизма действия ферментов - это теория промежуточных соединений (Михаэлис, Ментен).
E+S↔ES↔ES*↔EP↔E+P
- сближение и ориентация субстрата и активного центра энзима,
- образование ES-комплекса, эффект напряжения (индуцированное напряжение, при котором происходит дестабилизация субстрата и энергетический барьер снижается),
- акт катализа (кислотно-щелочной или ковалентный),
- выход конечных продуктов реакции из активного центра.
Кинетика, классификация, ингибирование ферментов
Дата добавления: 2017-09-19; просмотров: 1312;
