Физико-химические свойства белков. Простые и сложные белки.
Строение и свойства белков и ферментов
Вводная лекция.
Предмет и задачи биологической химии, ее значение для биологии и медицины. Важнейшие этапы в истории биохимии. Основные принципы биохимических исследований в медицине. Место биохимии среди других биологических дисциплин. Биохимия как молекулярный уровень изучения явлений жизни. Биохимия и медицина (значение клинической биохимии в диагностике и определении тактики лечения различных заболеваний).
Аминокислоты и структуры белка.
A–аминокислоты — это органические кислоты, у которых один из атомов водорода у α-С-атома замещен на аминогруппу. Классификация протеиногенных аминокислот возможна: по строению радикала, по полярности радикала, по степени незаменимости аминокислот, по кислотно-основным свойствам. Для аминокислот характерны следующие физико-химические свойства: ионизация (диссоциация карбоксильных и протонирование аминогрупп), изоэлектрическое состояние, изоэлектрическая точка, амфотерность аминокислот и их буферные свойства.
Белки –это высокомолекулярные азотсодержащие органические соединения, состоящие из аминокислот, соединенных пептидной связью в полипептидные цепи. Белки выполняют в организме многочисленные функции: ферментативную, гормональную, рецепторную, транспортную, структурную, иммунологическую и др. Белки имеют сложную форму структурной организации.
Первичная структура белка –это линейная последовательность аминокислот, соединенных между собой в цепь пептидными связями.
Вторичная структура белка - это способ укладки стержня пептидной цепи (первичной структуры) в упорядоченную a–спираль или b–структуру при помощи водородных связей.
Альфа-спираль (a-спираль) – вторичная структура, формируемая остовом полипептидной цепи. Она представляет собой правую спираль, у которой на один виток приходится 3,6 аминокислотных остатка. Спираль стабилизирована водородными связями между группами СО и NH различных мономерных звеньев, отстоящих друг от друга на расстояние 4 остатков аминокислот. Водородные связи направлены вдоль оси спирали.
Бета-структура - b-слой или «складчатый лист» - один из регулярных элементов вторичной структуры белка: между несколькими вытянутыми (деспирализованными) полипептидными цепями возникают водородные связи (между группами СО одной цепи и NН другой).
Третичная структура белка – способ укладки a–спирали или b–структуры в пространстве (глобулярные, фибриллярные белки). Третичную структуру стабилизируют ионные, водородные, ковалентные (дисульфидные) связи и гидрофобные взаимодействия.
Четвертичная структура белка –это объединение нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка.
Классификация белков осуществляется: по структурным признакам (простые и сложные); по электрохимическим признакам (кислые, основные и нейтральные); по полярным признакам (полярные [гидрофильные], неполярные [гидрофобные], амфифильные); по форме молекул (глобулярные, фибриллярные); по функциям (транспортные, белки–ферменты, гормоны, антитела, структурные и т.д.).
Характеристика (особенности аминокислотного состава, молекулярнуая масса, заряд, структура и функции) и основные представители простых белков (альбумины, глобулины, протамины, гистоны). Химический состав и структура сложных белков: белковая часть – апопротеин, небелковый компонент – простетическая группа. Принципклассификации(по названию простетической группы) и классы сложных белков.
Методы изучения аминокислот и белков: выделение, очистка, качественный и количественный анализ, хроматография, электрофорез.
Физико-химические свойства белков. Простые и сложные белки.
Белки — высокомолекулярные соединения. Гидролиз белка состоит из двух этапов: разрыва гидролизуемой связи и присоединения по месту разрыва фрагментов воды (Н- и НО- групп). Пептидная связь является ковалентной и химически устойчивой, поэтому гидролиз белков проводят в жестких условиях. Различают кислотный, щелочной и ферментативный способы гидролиза белков. Кислотный или щелочной гидролиз проводят кипячением белка в растворе кислоты или щелочи в течение длительного времени. При ферментативном гидролизе раствор белка инкубируют с энзимом при температуре, не выше 40◦ С.
В воде большинство белков образует истинные растворы. Однако, по причине высокой молекулярной массы и большого размера молекулы белка приобретают свойства коллоидных частиц, а растворы белка — свойства коллоидных растворов. Коллоидные растворы белка достаточно устойчивы. Это обусловлено: 1) наличием на белковой частице электрического заряда и 2) образованием вокруг белковой молекулы гидратной оболочки. Заряд на молекуле белка формируется при ионизации в воде карбокси- и аминогрупп: образуются ионы R-СОО - и NH3+ . Такие ионы на поверхности белковой частицы и полярные радикалы аминокислот (—ОН серина, —SH цистеина), притягивая диполи воды, способствуют образованию гидратной оболочки, обеспечивая, тем самым, растворимость. Факторы, влияющие па гидратную оболочку, заряд или структуру белковой молекулы, могут повысить или, наоборот, понизить растворимость молекул белка, изменить их физико-химические свойства и функциональную активность.
Белки, как и их структурные элементы – аминокислоты, благодаря одновременному присутствию СООН – групп (кислотных) и NН2 – групп (основных), являются амфотерными электролитами. В кислой среде они проявляют основные свойства и несут положительный заряд (катионы). В щелочной среде они проявляют кислотные свойства и несут отрицательный заряд (анионы):
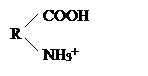 | |||
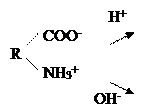 | |||
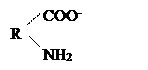 | |||
Однако, в зависимости от преобладания в молекуле дикарбоновых или диаминомонокарбоновых аминокислот, белки в водных растворах при рН=7 приобретают, соответственно, свойства либо слабых кислот или слабых оснований. Кислые белки (альбумины, глобулины) в водном растворе несут суммарный отрицательный заряд, основные белки (протамины, гистоны) – положительный заряд.
Растворимость белка, как правило, увеличивается при добавлении к раствору солей щелочных и щелочноземельных металлов (хлоридов и сульфатов натрия, калия, кальция, магния, аммония и др.) в небольших концентрациях (> 5 %). Однако, при дальнейшем повышении в растворе концентрации этих же солей растворимость белков может резко понижаться, они выпадают в осадок. При разбавлении этих растворов водой белки снова растворяются, восстанавливая свои специфические (нативные) свойства. Вышеописанный метод выделения белков называют высаливанием. Поскольку разные белки высаливаются (осаждаются) при различной концентрации солей, этот метод широко используется для фракционирования и получения относительно гомогенных белковых препаратов (альбуминов, глобулинов, белков-ферментов и др.).
Другой химизм имеет осаждение белков солями тяжелых металлов (ртути, серебра, меди, свинца, стронция и др.). Их токсическое действие основано на образовании с белками нерастворимых солей, что является причиной денатурации белков. Под влиянием различных физических и химических факторов (нагревания, действия ультразвука, ультрафиолетового и радиоактивного излучения, концентрированных кислот, щелочей, солей тяжелых металлов, органических соединений, алкалоидов и многих других) белки денатурируют. При этих воздействиях в молекуле белка происходит разрушение слабых связей (водородных, электростатических, гидрофобных), формирующих четвертичную, третичную и вторичную структуры. Полипептидная цепь разворачивается, и гидрофобные радикалы аминокислот понижают растворимость белка. При этом изменяются физико-химические и, главное, биологические (нативные) свойства белка.
Процесс разделения высокомолекулярных и низкомолекулярных частиц с помощью полупроницаемых мембран называется диализом. Метод основан на неспособности коллоидных частиц проникать через полупроницаемые мембраны. Обладая большим диаметром, частицы белка не способны к проникновению через такие мембраны. В то же время низкомолекулярные примеси легко проходят через поры полупроницаемых мембран. На основе диализа создан аппарат «искусственная почка». С помощью диализа могут быть получены очищенные от солей растворы белков.
Простые белки состоят только из аминокислот.
Сложные белки классифицируют в зависимости от простетической группы. Основная роль простетической группы: стабилизация третичной структуры белка и участие в выполнении биологической функции.
Фосфопротеины, наряду с апопротеином, содержат фосфорную кислоту. Присоединение или отщепление фосфорной кислоты изменяет активность ферментов (фосфорилаза и гликогенсинтаза). Второй тип фосфопротеинов – питательные белки (казеиноген).
К металлопротеинам относят макромолекулы, у которых, помимо белка, имеются ионы одного или нескольких металлов. Например, белки, содержащие негеминовое железо (ферритин, трансферрин), ионыцинка (алкогольдегидрогеназа, карбоангидраза), меди (тирозиназа, цитохромоксидаза), натрий, калий, кальций, магний (АТФ-азы и многие др. ферменты).
Дата добавления: 2017-09-19; просмотров: 1419;
