Уравнение состояния газов.
Основные понятия химии
Превращение одних веществ в другие называется химическими рекциями. Внешние признаки химических реакций: 1) выделение теплоты (иногда света); 2) изменение окраски; 3) появление запаха; 4) образование осадка; 5) выделение газа.
Следует отличать физические превращения от химических явлений. Например, горение угля С + О2 = СО2.
Физическими называют такие явления, при которых данные вещества не превращаются в другие, а обычно изменяется только их агрегатное состояние или форма: плавление льда.
Каждое вещество обладает определенным набором химических свойств, которые и определяют его участие в химических реакциях.
От химических свойств следует отличать физические свойства: Важнейшими физическими свойствами веществ являются:
1) агрегатное состояние (твердое, жидкое, газообразное);
2) цвет;
3) плотность;
4) температуры кипения и плавления;
5) тепло- и электропроводность;
6) растворимость в воде и других жидкостях;
7) вкус и запах и т.д.
Химические свойства не зависят от агрегатного состояния, а физические – зависят. Так, сера в любом агрегатном состоянии при сгорании образует SO2, то есть проявляет одно и то же химическое свойство, но ее физические свойства в разных агрегатных состояниях различны. Например, плотность твердой серы 2,1 г/см3, жидкой – 1,8 г/см3, газообразной – 0,004 г/см3.
Молекула - это мельчайшая частица вещества, которая сохраняет его химические свойства. Атомы – это мельчайшие химически неделимые частицы. Каждый отдельный вид атомов называется химическим элементом.
Основные положения атомно-молекулярного учения следующие:
1. Молекулы и атомы находятся в непрерывном и беспорядочном движении.
1827 г., английский ученый Броун увидел в микроскоп движение твердых частиц в жидкости. Частицы движутся непрерывно и беспорядочно. Это явление назвали броуновским движением.
Скорость движения частиц зависит от температуры. С повышением температуры скорость движения молекул возрастает.
2. Между молекулами существуют промежутки, размеры которых зависят от агрегатного состояния и температуры.
Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
При изменении температуры объем тела изменяется. Между молекулами есть промежутки. При нагревании тела промежутки увеличиваются, при охлаждении – уменьшаются.
3. Между молекулами существуют силы взаимного притяжения и отталкивания.
В наибольшей степени эти силы выражены в твердых телах, в наименьшей – в газах.
4. При физических явлениях молекулы сохраняются, при химических – разрушаются. При химических реакциях атомы сохраняются и происходит их перегруппировка.
Все вещества делятся на простые и сложные. Вещества, которые состоят из атомов одного элемента, называются простыми, например сера S, водород Н2, кислород О2, железо Fe. Вещества, которые состоят из атомов разных элементов, называются сложными.Например, вода Н2О, мел CaCO3.
Понятие «простое вещество» нельзя отождествлять с понятием «химический элемент». Простое вещество характеризуется определенной плотностью, растворимостью, температурами кипения и плавления и др. Химический элемент характеризуется определенным положительным зарядом ядра (порядковым номером), степенью окисления, изотопным составом и др. Свойства элемента относятся к его отдельным атомам. Сложные вещества состоят не из простых веществ, а из элементов. Например, вода состоит не из простых веществ водорода и кислорода, а из элементов водорода и кислорода. Названия элементов совпадают с названиями соответствующих им простых веществ, за исключением углерода.
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образовавшиеся вещества аллотропными видоизменениями или модификациями. Явление аллотропии вызывается двумя причинами: 1) различным числом атомов в молекуле, например кислород О2 и озон О3; 2) образованием различных кристаллических форм, например алмаз, графит, карбин, фуллерен (С60 – С70).
Абсолютные массы атомов и молекул очень маленькие величины. Например, масса атома углерода 19,93´10-24 г. Использовать такие числа при расчетах неудобно. Поэтому при расчетах используют относительную величину – относительную атомную массу элемента.
Относительная атомная масса элемента – величина, равная отношению массы атома элемента к 1/12 (одной двенадцатой) массы атома углерода–12.
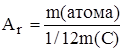
Одна двенадцатая массы атома углерода-12, равная 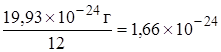 г, называется атомной единицей массы (а.е.м.).
г, называется атомной единицей массы (а.е.м.).
Относительная молекулярная масса вещества – величина, равная отношению массы молекулы вещества к 1/12 массы атома углерода-12.
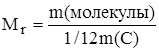
Числовое значение относительной молекулярной массы равно суммe относительных атомных масс атомов, из которых состоит молекула. Например, относительная молекулярная масса воды
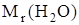 =
= 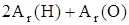 = 2×1,00797+ 1×15,9994 = 18,01534.
= 2×1,00797+ 1×15,9994 = 18,01534.
Задание. Рассчитать относительную молекулярную массу стекла Na2O×CaO×6SiO2.
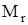 (Na2O×CaO×6SiO2)=
(Na2O×CaO×6SiO2)= 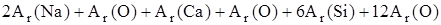 = 2×23+ 16 +40+16+6×28 + 12×16 = 478.
= 2×23+ 16 +40+16+6×28 + 12×16 = 478.
Моль — это количество вещества, содержащее столько частиц (молекул, атомов, ионов или других), сколько содержится атомов в 12 граммах углерода 12С. Количество вещества обозначают n.
Задание. Сколько моль атомов содержится в 1 моле серной кислоты?
n(H) = 2 моль, n(S) = 1 моль, n(O) = 4 моль.
В одном моле вещества содержится 6,02´1023 частиц (молекул, атомов).
1 атом С имеет массу 19,93 × 10-24 г
х частиц имеют массу 12 г
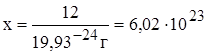
Эта величина называется постоянной Авогадро и обозначается
NA = 6,02´1023 моль-1.
Число частиц рассчитывают по формуле N = n×NA.
Задание.Сколько атомов кислорода содержится в 8-ми молях нитрата кальция Ca(NO3)2?
n(O) = 6×8=48, N(O) = 48 × 6,02×1023 = 289 ×1023 атомов.
Масса одного моля частиц называется его молярной массой (обозначается буквой M).
Молярную массу вещества можно рассчитать по формуле
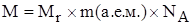 =
= 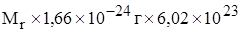 моль-1 =
моль-1 =
= Mr × 1 г/моль
или
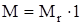 г/моль,
г/моль,
Числовое значение молярной массы вещества М равно относительной молекулярной массе (Mr).
Молярная масса – это величина, равная отношению массы вещества (m) к количеству вещества (n): 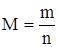
Задача.Рассчитать количество молекул, образующих 100 г углекислого газа, число атомов кислорода, входящие в эту массу, а также массу двух молекул углекислого газа.
Рассчитаем количество вещества n (СО2), соответствующее массе оксида равной 100 г.
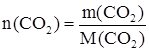 ;
; 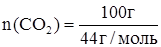 ;
;  » 2,273 моль.
» 2,273 моль.
Рассчитаем количество молекул, входящих в состав 100 г СО2.
N(CO2) = n(CO2) × NA; N(CO2) = 2,273 × 6,02 ×1023;
N(CO2) = 13,68 × 1023 молекул.
n(O) =2 × 2,273 моль, n(O) =2 × 2,273 моль = 4,546, N(O) = 4,546 × 6,02 ×1023 = 27,367 ×1023;
Рассчитаем массу одной молекулы.
m1(CO2) = n1(CO2)×M = 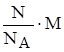 =
= 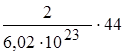 =; m(CO2)=14,6 × 10-23 г.
=; m(CO2)=14,6 × 10-23 г.
Стехиометрические законы
Стехиометрия – раздел химии, в котором рассматриваются массовые и объемные отношения между реагирующими веществами.
1. Закон сохранения массы веществ сформулирован М.В. Ломоносовым (1748 г): Общая масса веществ, которые вступают в химическую реакцию, равна суммарной массе веществ, которые образуются в результате реакции.
Французский химик Лавуазье в 1789 г. подтвердил этот закон и сделал вывод: масса каждого атома, который участвует в реакции, не изменяется в этой реакции, то есть при химических реакциях одни элементы не превращаются в другие.
Однако данный закон справедлив только для изолированной системы. Если же система открытая, то имеет место энергетический эффект (выделение или поглощение теплоты), следовательно, массы исходных веществ и продуктов различаются, что выражается уравнением Эйнштейна:
DE = Dmc2,
где DE – изменение энергии; Dm – изменение массы вещества; c – скорость света в вакууме (3×108 м/с). Масса может переходить в энергию и наоборот. Тем не менее, для химических превращений, в отличие от ядерных, данные эффекты невелики и изменение массы незначительно.
2. Закон постоянства состава.Сформулирован Прустом в 1799 г: Всякое чистое вещество независимо от способа его получения и местонахождения имеет постоянный качественный и количественный состав.
Например, вода может быть продуктом различных химических процессов:
NaOH + HCl ® NaCl + H2O
2H2 +O2 ® 2H2O.
При этом во всех случаях образуются молекулы одной природы, состоящие из двух атомов водорода и одного атома кислорода.
Закон постоянства состава не носит всеобщего характера. По современным представлениям существуют вещества с молекулярным (в основном жидкие и газообразные) и немолекулярным (в основном твердые) строением. Вещества с немолекулярной структурой состоят из атомов или ионов и называются макротелами. Кроме того, наряду с соединениями постоянного состава (дальтониды), существуют соединения переменного состава (бертоллиды). В связи с этим в современную формулировку закона вносят уточнение: Состав соединений молекулярной структуры является постоянным независимо от способов получения, состав соединений с немолекулярной структурой зависит от условий получения.
3. Закон объемных отношенийсформулирован в 1808 г. Гей-Люссаком: Объемы газообразных веществ, вступающих в реакцию, и объемы газообразных продуктов реакции при одинаковых условиях (давление, температура) относятся между собой как простые целые числа.
Например, при взаимодействии азота и водорода с образованием аммиака протекает реакция
N2 + 3H2 = 2NH3.
V (N2) :V (H2) V (NH3) = 1 : 3 : 2.
4. Закон Авогадро сформулирован в 1811 г.: В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Экспериментально было установлено, что молекулы простых газов (водорода, кислорода, азота, фтора, хлора и др.) состоят из двух атомов. Наиболее простой пример: в результате реакции водорода с хлором образуется 2 объема хлороводорода, а не один.
H2 + Cl2 = 2HCl
Следствия из закона Авогадро:
1) Один моль любого газа при одинаковых условиях занимает один и тот же объем.
При нормальных условиях (н. у.) (t = 0°С и Р=101325 Па) 6,02×1023 молекул (1 моль) любого газа занимают объем, равный 22.4 л. Этот объем называется молярным объемом газа Vm.
Vm = V/n, V = nVm,
Vm = M/ 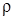
Vm измеряется в л/моль; r – плотность измеряется в г/л.
Задание.Определить Mr газа, если при н.у. его плотность равна 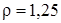 г/л.
г/л.
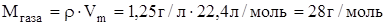
Mr= 28
Задание. Определить молярную массу газа, если 4,2 г газа занимают при н. у. объем 3 л.
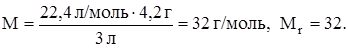
2) Массы равных объемов различных газов при одинаковых условиях относятся как относительные молекулярные (или молярные) массы этих газов. Отношение масс газов, находящихся в равных объемах при одинаковых условиях, называется относительной плотностью одного газа по другому D.
D = m1/m2 или D = M1/M2
Задание. Определить относительную плотность сероводорода по воздуху.
Относительная молекулярная масса воздуха 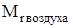 = 29, поэтому относительную плотность газа по воздуху рассчитывают по формуле
= 29, поэтому относительную плотность газа по воздуху рассчитывают по формуле
D = M(H2S)/M(воздуха)

Относительная плотность показывает, во сколько раз один газ тяжелей другого.
Уравнение состояния газов.
Для каждой однородной системы справедливо соответствующее уравнение состояния, которое связывает между собой ее объем, давление и температуру. Для идеальных газов, для которых расстояние между образующими их частицами (молекулы, атомы) гораздо больше размеров самих частиц и можно пренебречь взаимодействием между ними в виду его малости, такое уравнение имеет вид
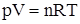
Это уравнение называется уравнение Менделеева – Клапейрона. Отметим, что Р – давление, создаваемое газом или суммарное давление всех компонентов газовой смеси, V – объем, Т - температура по шкале Кельвина
(0°С=273 К) и R – универсальная газовая постоянная, равная в Международной системе единиц 8,31 Дж/(моль×К).
Ели давление измеряется в Па, то объем – в м3, или, соответственно, давление в кПа, а объем – в л.
1 л = 10–3 м3; 1 кПа = 103 Па.
Задание.Газ массой 30,3 г заполнил сосуд вместимостью 15 л при температуре 180С. Давление газа внутри сосуда составляет 12200 Па. Рассчитайте молярную массу газа.
М = 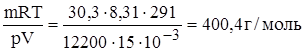
5. Закон эквивалентов.Эквивалентом элемента называют такое его количество, которое соединяется с одним моль атомов водорода или замещает то же количество атомов водорода в химических соединениях.
Э(элемента) = 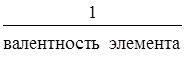 , моль-экв. (Валентность – это число химических связей, образуемых данным атомом).
, моль-экв. (Валентность – это число химических связей, образуемых данным атомом).
Всегда Э(Н) = 1 моль-экв, Э(О) = ½ моль-экв.
Масса одного эквивалента элемента называется его эквивалентной массой.
МЭ (элемента) = М(элемента)×Э(элемента), г/моль-экв.
Всегда МЭ(Н) = 1 г/моль-экв, МЭ(О) = 8 г/моль-экв,
Задание.Определить эквивалент и эквивалентную массу азота в NH3 и углерода в метане CH4.
Э(N) = 1/3 моль-экв, МЭ (N) = 14/3 = 4,67 г/моль-экв;
Э (С) = 1/4 моль-экв, МЭ (С) = 12/4 = 3 г/моль-экв.
Задание.Определите эквивалентную массу азота в оксиде N2O.
МЭ (N) = 14/1 = 14 г/моль-экв
Эквивалент оксида равен:
Э(оксида) = 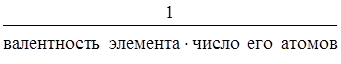 .
.
МЭ (оксида) = М(оксида)×Э(оксида).
Задание. Определить эквивалентную массу оксида азота NО2.
МЭ (NО2)= 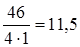 г/моль-экв.
г/моль-экв.
Эквивалент кислоты равен:
Э (кислоты)= 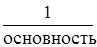 . Основность – это число атомов водорода в молекуле кислоты.
. Основность – это число атомов водорода в молекуле кислоты.
МЭ (кислоты) = М(кислоты)×Э(кислоты).
Задание.Определить эквивалентную массу угольной кислоты Н2СО3.
МЭ (Н2СО3)= 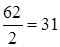 г/моль-экв.
г/моль-экв.
Эквивалент основания равен:
Э(основания) = 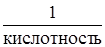 . Кислотность – это число гидроксогрупп в молекуле основания.
. Кислотность – это число гидроксогрупп в молекуле основания.
МЭ (основания) = М(основания)×Э(основания).
Задание.Определить эквивалентную массу гидроксида алюминия Al(OH)3.
МЭ (Al(OH)3)= 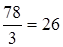 г/моль-экв.
г/моль-экв.
Эквивалент соли равен:
Э(соли) =  .
.
МЭ (соли) = М(соли)×Э(соли).
Задание.Определить эквивалентную массу сульфата железа (III) Fe2(SO4)3.
МЭ (Fe2(SO4)3)= 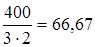 г/моль-экв.
г/моль-экв.
Рихтер сформулировал закон: Массы веществ, которые вступают в реакцию и образуются в результате реакции, пропорциональны их эквивалентам или эквивалентным массам.
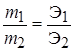 или
или  .
.
Задание.При соединении 1,50 г натрия с хлором образовалось 3,81 г хлорида натрия. Найти эквивалентную массу натрия, если эквивалентная масса хлора 35,45 г/моль-экв.
m(Cl) = m(NaCl) – m(Na) = 3,81 – 1,50 = 2,31 г.
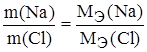 ,
, 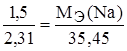 ,
, 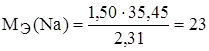 г/моль-экв.
г/моль-экв.
Задание. Рассчитайте эквивалентную массу и валентность железа, если 22,4 г железа соединяются с 9,6 г кислорода.
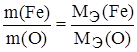 ;
; 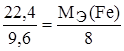 , МЭ(О) = 16/2=8 г/моль-экв.
, МЭ(О) = 16/2=8 г/моль-экв.
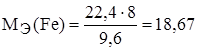 г/моль-экв.
г/моль-экв.
МЭ (Fe) = М (Fe)×Э(Fe), Э(Fe) = 1/валентность, МЭ (Fe) = 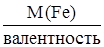 ,
,
Валентность = 56/18,67 = 3.
Дата добавления: 2017-09-19; просмотров: 981;
