Характеристики ковалентной связи
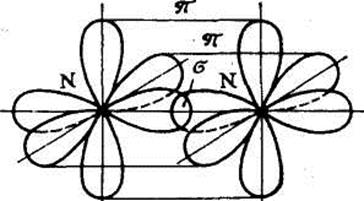
1. Пространственная направленность. Если электронные облака перекрываются в направлении прямой, которая соединяет ядра атомов, такая связь называется s-связью (s–s-перекрывание Н2, р–рCl2, s–рHC1).
При перекрывании p-орбиталей, направленных перпендикулярно оси связи, образуются две области перекрывания по обе стороны оси связи. Такая ковалентная связь называется p-связью. Например, в молекуле азота атомы связаны одной s-связью и двумя p-связями.
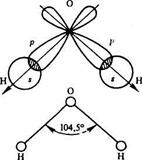
Направленность связи определяет пространственную структуру молекул, т. е. их форму и характеризуется наличием строго определенного угла между связями. Например, угол между s-связями в молекуле воды равен 104,5°.
2. Полярность связи определяется асимметрией в распределении общего электронного облака вдоль оси связи.
Если общие электронные пары располагаются симметрично относительно обоих ядер, то такая ковалентная связь называется неполярной.
Если общие электронные пары смещаются к одному из атомов (располагаются несимметрично относительно ядер различных атомов), то такая ковалентная связь называется полярной.
В случае, когда электронная пара смещается в сторону более электроотрицательного атома центры (+) и (–) зарядов не совпадают, и возникает система (электрический диполь) из двух равных по величине, но противоположных по знаку зарядов, расстояние между которыми (l) называют длиной диполя. Мерой полярности молекул является электрический момент диполя m, равный произведению абсолютного значения заряда электрона
(q = 1,6 × 10–19 Кл) на длину диполя l:
m = q×l.
Единицей измерения m является дебай D, 1 D = 3,33×10–30 Кл×м.
Задание.Длина диполя молекулы HCl равна 2,2×10–9 см. Вычислить электрический момент диполя.
2,2×10–9 см = 2,2×10–11 м
m = 1,6 × 10–19 ×2,2×10–11 = 3,52×10–30 Кл×м = 3,52×10–30/3,33×10–30 = 1,06 D.
3. Кратность ковалентной связи определяется числом общих электронных пар, которые связывают атомы. Связь между двумя атомами при помощи одной пары электронов называется простой (связи Н – С1, С – Н, Н – О и т. д.). Связь при помощи двух электронных пар называется двойной (этилен Н2С = СН2), при помощи трех электронных пар – тройной (азот N 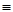 N, ацетилен Н – С
N, ацетилен Н – С 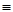 С – Н).
С – Н).
4. Длина связи – это равновесное расстояние между ядрами атомов. Длину связи выражают в нанометрах (нм). 1 нм = 10–9 м. Чем меньше длина связи, тем прочнее химическая связь.
5. Энергия связи равна работе, которую необходимо затратить на разрыв связи. Выражают энергию связи в килоджоулях на моль (кДж/моль). Энергия связи увеличивается с уменьшением длины связи и с увеличением кратности связи. Процесс образования связи протекает с выделением энергии (экзотермический процесс), а процесс разрыва связи – с поглощением энергии (эндотермический процесс).
Гибридизация
Гибридизация – выравнивание орбиталей по форме и энергии.
Sp-гибридизация
Рассмотрим на примере гидрида бериллия ВеН2. Электронное строение атома Ве в нормальном состоянии 1s22s2. Атом бериллия может вступать во взаимодействие с атомами водородом только в возбужденном состоянии (s ® р-переход).
Ве – 1s22s12p1
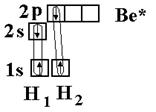
Две образующиеся связи должны быть различны по энергии, так как возникновение одной связано с перекрыванием двух s-орбиталей, вто-
рой – s- и p-орбиталей. Тогда и атомы водорода в молекуле должны быть химически неравноценны: один более подвижен и реакционноспособен, чем другой. Экспериментально это не так – оба атома водорода энергетически равноценны. Для объяснения этого явления Дж.К. Слейтер и Л. Полинг предположили, что «при интерпретации и расчете углов между связями и длины связи целесообразно близкие по энергии связи заменить равным количеством энергетически равноценных связей». Возникающие подобным образом связи являются гибридными.
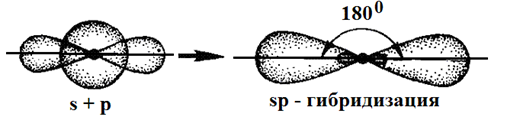
Таким образом, одна s- и одна р-орбиталь атома бериллия заменяются двумя энергетически равноценными sp-орбиталями, располагающимися под углом 180о друг к друг, т.е. молекула имеет линейное строение.
Sp2-гибридизация
Рассмотрим на примере молекулы гидрида бора ВН3. Электронное строение атома бора в нормальном состоянии следующее В – 1s22s22p1. Он может образовать только одну ковалентную связь. Три же ковалентные связи для атома бора характерны только в возбужденном состоянии В* – 1s22s12p2
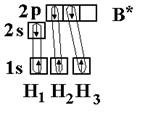
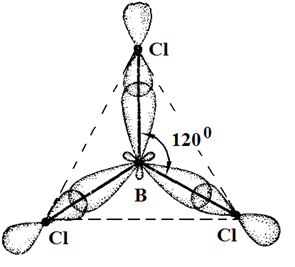
Одна связь, образованная при перекрывании двух s-орбиталей атомов В и Н, энергетически не отличается от двух других, образуемых перекрыванием s- и р-орбиталей. Три sp2-гибридные орбитали расположенные под углом 120о друг к другу, молекула имеет плоское строение. Подобная картина характерна для любых четырехатомных молекул, образованных за счет трех sp2-гибридных связей, например, для хлорида бора (BCl3).
Sp3-гибридизация
Рассмотрим на примере метана СН4. В нормальном состоянии атом углерода с электронным строением 1s22s22p2 может дать только две ковалентные связи. В возбужденном состоянии он способен быть четырехвалентным с электронным строением 1s22s12р3.
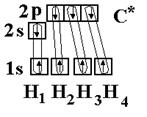
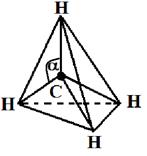
Гибридными становятся одна s- и три р-орбитали атома углерода, при этом образуются четыре sp3-гибридные, энергетически равноценные орбитали. Молекула метана приобретает тетраэдрическое строение. В центре тетраэдра, все вершины которого геометрически равноценны, находится атом углерода, а в его вершинах атомы водорода. Угол между связями составляет 109о28¢.
Силы взаимодействия между молекулами называют ван-дер-ваальсовыми или межмолекулярными. Это взаимодействие обусловлено электростатическим притяжением между отдельными молекулами и характеризуется следующими особенностями:
- действует на сравнительно больших расстояниях, существенно превосходящих размеры самих молекул;
- характеризуется малой энергией, поэтому существенно ослабевает с повышением температуры;
- является ненасыщающимся, т. е. взаимодействие данной молекулы со второй не исключает подобного эффекта по отношению к третьей, четвертой и т. д.
С ростом относительных молярных масс силы межмолекулярного взаимодействия возрастают и, как следствие, повышаются температуры плавления и кипения веществ.
Ионная связь
Принято считать связь ионной, если разница электроотрицательностей атомов ΔЭО > 1,9.
Задание. Вычислить разность электроотрицательностей атомов ΔЭО для связей O–H и О–Мg в соединении Мg(ОН)2 и определить какая из этих связей более полярна. ЭО(Н) = 2,1 эВ, ЭО(О) = 3,5 эВ, ЭО(Mg) = 1,2 эВ.
Решение:
ΔЭО(O–H) = 3,5 – 2,1 = 1,4; ΔЭО(O–Mg) = 3,5 – 1,2 = 2,3.
Таким образом, связь Mg–О более полярна.
При образовании соединений из элементов, очень отличающихся по электроотрицательности (типичных металлов и типичных неметаллов), общие электронные пары полностью смещаются к более электроотрицательному атому. Например, при горении натрия в хлоре неспаренный 3s-электрон атома натрия спаривается с 3p-электроном атома хлора. Общая электронная пара полностью смещается к атому хлора (Δχ(Cl) = 2,83 эВ, Δχ(Cl) = 0,93 эВ). Чтобы ионная связь возникла необходимо:
1. Наличие атома с четко выраженной тенденцией к отдаче электрона с образованием положительно заряженного иона (катиона), т.е. с малой ЭИ. Потенциал ионизации – энергия, которую необходимо затратить для удаления 1-го электрона с внешней орбитали. Чем меньше потенциал ионизации, тем легче атом теряет электроны, тем сильнее выражены у элемента металлические свойства. Потенциал ионизации растет в пределах периода слева направо, уменьшается сверху вниз.
Процесс отдачи электронов называется окислением.
Na –e ® Na+
2. Наличие атома с четко выраженной тенденцией к присоединению электрона с образованием отрицательно заряженных ионов (анионов), т.е. с большим СЭ. Процесс присоединения электронов называется восстановлением.
Cl + e ® Cl–
Типичные ионные соединения образуются при соединении атомов металлов главных подгрупп I и II групп с атомами неметаллов главной подгруппы VII группы (NaCl, KF, СаС12).
Между ионной и ковалентной связью нет резкой границы. В газовой фазе вещества характеризуются чисто ковалентной полярной связью, но эти же вещества в твердом состоянии характеризуются ионной связью.
Дата добавления: 2017-09-19; просмотров: 975;
