ПЗ и ПС в свете учения о строении атомов
Число электронных слоев в атоме любого элемента равно номеру периода, в котором он находится. Число электронов во внешнем слое не может быть больше восьми и для атомов элементов главных подгрупп(кроме гелия He) равно номеру группы. Электронные слои, орбитали которых имеют 8 электронов, называются завершенными. У элементов главных подгрупп заполняются s- и p-орбитали последнего слоя. У элементов побочных подгрупп заполняются d- и f(лантаноиды и актиноиды)-орбитали последнего слоя. Таким образом, все элементы ПС образуют четыре семейства.
Энергия ионизации (ЭИ) – это количество энергии, необходимое для отрыва электрона от атома с образованием катиона. Способность атома отдавать электроны называется восстановительной способностью.
Сродство к электрону(СЭ) – это количество энергии, которое выделяется при присоединении одного электрона к нейтральному атому. Способность атома принимать электроны называется окислительной способностью.
Электроотрицательность (ЭО) – способность атома притягивать к себе электроны. ЭО элемента определяется суммой его ЭИ и СЭ.
Изменение свойств атомов, простых и сложных веществ в ПС
| В главных подгруппах сверху вниз | В периодах слева направо |
| 1. Заряд ядра | |
| увеличиваются | увеличиваются |
| 2. Число энергетических уровней | |
| увеличивается | const, равно номеру периода |
| 3. Число е на внешнем уровне | |
| const, равно номеру группы | увеличивается |
| 4. Радиус атома | |
| увеличивается (т.к. увеличивается число энергетических уровней) | уменьшается (т.к. растет положительный заряд ядра, притяжение е-ов к ядру усиливается, атом «сжимается») |
| 5. ЭИ | |
| уменьшается | увеличивается |
| 6. Восстановительные свойства | |
| увеличиваются | уменьшаются |
| 7.СЭ | |
| уменьшается | увеличивается |
| 8. Окислительные свойства | |
| уменьшение | увеличиваются |
| 9. ЭО | |
| уменьшается (т.к. радиус растет) | увеличивается (т.к. заряд ядра увеличивается) |
| 10. Металлические свойства | |
| усиливаются (самый активный металл – франций (Fr)) | ослабевают |
| 11. Неметаллические свойства | |
| ослабевают | усиливаются (самый активный неметалл – фтор (F)) |
| 12. Осно¢вные свойства | |
| усиливаются | ослабевают |
| 13. Кислотные свойства | |
| ослабевают | усиливаются (основное в-во ® амфотерное в-во ® кислотное в-во) |
Число электронов во внешнем слое атомов изменяется периодически с возрастанием заряда ядер атомов. Поэтому и свойства химических элементов изменяются периодически. В настоящее время периодический закон формулируется так:
Свойства химических элементов, а также формы и свойства их соединений, находятся в периодической зависимости от величины заряда их атомных ядер или порядкового номера элемента в периодической системе.
Химическая связь
Химическая связь – это вид межатомных взаимодействий в молекулах, ионах, кристаллах, характеризуемый определенной энергией. При всем многообразии химических связей их природа едина и носит электростатический характер.
Валентные электроны – электроны предвнешнего и внешнего электронных слоев, участвующие в образовании химической связи. Валентность – это свойство атомов элемента образовывать химическую связь, она определяется числом этих связей.
Ковалентная связь
Ковалентная связь образуется за счет общих электронных пар, возникающих на внешних и предвнешних подуровнях связываемых атомов.
Ковалентная связь бывает двух типов: неполярная и полярная.
Неполярная связь возникает между атомами неметалла одного химического элемента, т.е. атомами с одинаковой электроотрицательностью (O2, N2, Cl2).
Рассмотрим образование молекулы водорода Н2. Электронная конфигурация атома водорода 1s1, т. е. на внешнем электронном слое (он единственный) находится один неспаренный электрон. При образовании молекулы водорода из двух атомов, имеющих непарные s-электроны с антипараллельными спинами, происходит перекрывание s-орбиталей и образуется общая электронная пара (рис. 4а).

Рис. 4. Перекрывание: а - s-орбиталей; б- s- и р-орбиталей;
в - р-орбиталей.
 |
Схематически это можно изобразить с помощью электронных формул:
Н··+ ·Н ® Н : Н
Если общие электронные пары обозначать чертой, то электронная формула превращается в структурную:
Н–Н
Общая электронная пара одинаково принадлежит обоим атомам, каждый атом получает устойчивую оболочку из двух электронов. Наибольшая электронная плотность общего электронного облака проявляется в области между ядрами. Молекула водорода образуется за счет взаимодействия общей электронной пары с ядрами обоих атомов.
Задание. Изобразить схему образования молекулы хлороводорода.
Cl 1s22s22p63s23p5; Н 1s1
Общая электронная пара смещается к атому с большей электроотрицательностью. ЭО (Cl) = 2,83 эВ, ЭО(Н) = 2,1 эВ.
Н··+ · 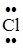 : ®
: ® 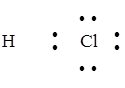
H–Cl
Электронная пара смещена к атому хлора, т.к. ЭО(Cl) > ЭО(Н).
Дата добавления: 2017-09-19; просмотров: 1018;
