Получение полиэфира лавсан
Возможность получения волокнообразующихся полиэфиров была впервые доказана Карозерсом и Арвином в 1929г путем поликонденсации гликолей и дикарбоновых кислот жирного ряда. Отдельные звенья макромолекулы полиэфира связаны между собой сложноэфирными группами
- С – О –
││
О
Откуда и произошло их название. Однако полиэфиры, полученные ими имели температуру плавления ниже 100оС (65-95оС) и поэтому не представляли существенного интереса для производства синтетических волокон.
Исследование в области полиэфиров, пригодных для производства волокон были продолжены английскими химиками Уинфилдом и Диксоном.
В 1941 г они получили высокоплавкие полиэфиры, образующие прочные нити, используя для этого не алифатическую, а ароматическую дикарбоновую кислоту - терефталевую, карбоксильные группы которой находятся в пара-положении. Волокно из полиэфира терефталевой кислоты получено в 1944 г, а в 1949 г в Англии была введена первая производственная установка по синтезу ПЭ и получения из них лавсана.
Доступность исходного сырья, ценные свойства волокна, превосходящие по отдельным показателям другие синтетические волокна, обусловили широкое развитие производства для изготовления технических изделий и предметов народного потребления.
Применяется лавсан в производстве:
- волокон и нитей для изготовления трикотажа и тканей различных типов (тафта, жоржет, креп, твид, атлас, кружево, тюль, плащевые и зонтичные полотна и т.п.);
- пленок, бутылей, упаковочного материала, контейнеров и др.;
- транспортерных лент, приводных ремней, канатов, парусов, рыболовных сетей и тралов, бензо- и нефтестойких шлангов, электроизоляционных и фильтровальных материалов, щёток, застёжек "молния", струн ракеток и т.п.;
- хирургических нитей и материалов для имплантации в сердечно-сосудистой системе (эндопротезы клапанов сердца и кровеносных сосудов), эндопротезирования связок и сухожилий.
Сырьё
Исходным сырьем для синтеза полиэфира (ПЭТ) является:
- терефталевая кислота (ТФК) и её диметиловый эфир – диметилтерефталат (ДМТ);
- этиленгликоль (ЭГ);
- оксид этилена (ОЭ).
2.1 Терефталевая кислота
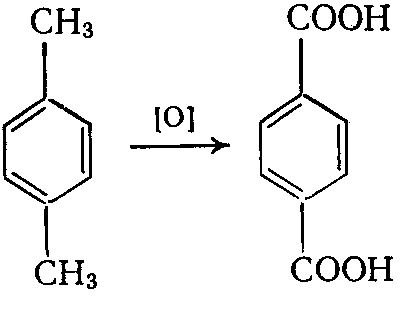
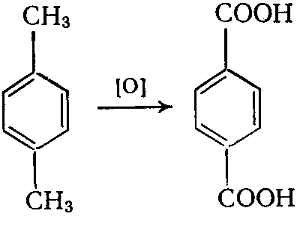
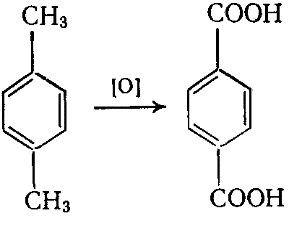
Из методов промышленного производства ТФК наибольший интерес представляет одностадийное окисления n-ксилола: получают терефталевую кислоту.
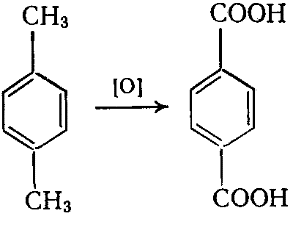
Окисление проводят на воздухе при 200оС и избыточном давлении 1,5 МПа в среде уксусной кислоты в присутствии солей марганца или кобальта.
Терефталевая кислота должна быть симметричного строения (пара-положения, а не орто- и мета-) для получения высокоплавкого полимера. В производственных условиях ПЭТ получают не из ТК, а из её диметилового эфира – ДМТ. Чистый продукт пригодный для синтеза полимера необходимого молекулярного веса проще получить, использовав поликонденсацию диметилового эфира.
ТФК является основным продуктом определяющим стоимость получаемого полиэфира. Она примерно в 5 раз дороже другого компонента, используемого для синтеза полиэфира – этиленгликоля.
2.2 Диметилтерефталат
Этерификацией метиловым спиртом (метанолом) при 200-300оС и давлении 10-20 МПа по схеме:
| СООН3 |

| СООН3 |
| терефталевая кислота |
| диметилтерефталат |
Для окисления ксилола используют азотную кислоту или кислород воздуха. полученный ДМТ очищают путем перекристаллизации (или дистилляции) из метилового спирта или бензола, в котором он растворяется.
Представляет собой белое кристаллическое вещество с температурой плавления 140,6 оС, кипения 288оС.
Процесс одностадийный (если используется азотная кислота или кислород воздуха).
Существует и 2х стадийный процесс и в ряде случаев он более экономичен. На первой стадии тоже под действием кислорода получается n-толуиловая кислота, которая затем окисляется в терефталевую.
Двухстадийный способ получения ДМТ представлен на рисунке 2.2.1.
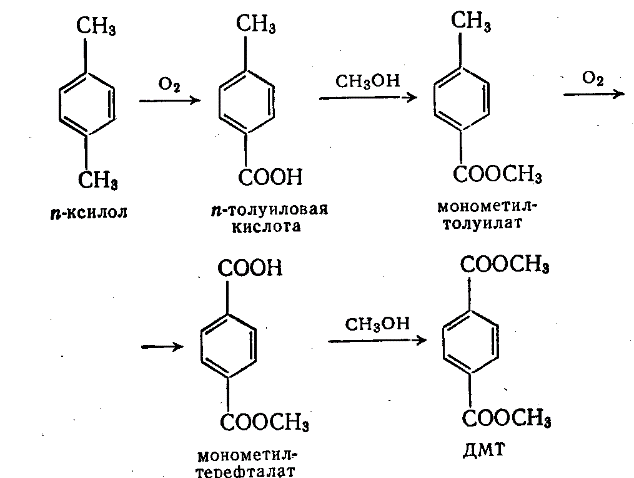
Рис 80 – Двух стадийный способ получения ДМТ
2.3 Этиленгликоль
Прозрачная бесцветная жидкость с температурой замерзания минус 11-13оС, самовоспламенения 413-415оС, кипения 197оС. Производится в промышленных масштабах. Находит широкое применение в технике для приготовления антифризов, а также как пластификатор или растворитель.
Его получают из этилена путем каталитического окисления до окиси этилена кислородом воздуха и последующей гидратации её.
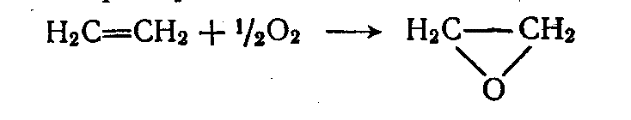
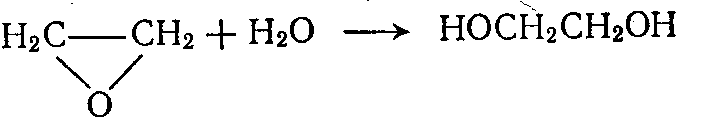
Этилен Окись этилена Этиленгликоль
ЭГ, применяемый для синтеза ПЭТ тщательно очищают, т.к. даже небольшое количество примесей оказывает влияние на качество полиэфира. Особенно вредно наличие хлорсодержащих веществ и высококипящих одноатомных спиртов, а также примесей ди- и полигликолей, которые снижают температуру плавления получаемого полимера и его термостабильность. Содержание их не должно превышать 0,2%.
Синтез ДГТ
Исходным продуктом для синтеза полиэтилентерефталата является дигликолевый эфир терефталевой кислоты (ДГТ) – диэтиленгликольтерефталат.
В настоящее время известны три промышленных метода получения ДГТ:
- переэтерификацией ДМТ этиленгликолем;
- этерификацией ТФК этиленгликолем;
- оксилиэтилирование ТФК.
Из перечисленных методов первый наиболее распространен вследствие тщательной разработки технологии получения ПЭТ и ДМТ, а в перспективе предпочтение отдается второму способу.
3.1 Переэтерификация ДМТ этиленгликолем
Суть реакции заключается во взаимодействии сложного эфира (ДМТ) и двухатомного спирта (ЭГ), в результате чего происходит обмен эфирных групп, в данном случае замена метильных групп на оксиэтильные (гликолевые):

При этом получают очень чистый продукт. Реакция протекает при 160-200оС. Применяют катализаторы (0,02-0,08% от массы ДМТ). Степень завершенности процесса переэтерификации можно контролировать по количеству выделившегося метанола. Для сокращения времени реакции процесс ведут до выделения и отгонки 75-90% расчетного количества метанола.
3.2 Этерификация ТФК этиленгликолем
Соотношение компонентов при 200оС ТФК:ЭГ, 1:1,5-2,0), с применением катализаторов (фосфористая кислота…). Продолжительность 6-8 часов. Для ускорения реакции температуру повышают до 220-240оС в среде олигомеров – продуктов этерификации, при избыточном давлении 0,2-1 МПа (предпочтительнее, т.к. меньше затраты сырья)
Этерификация - это обычная реакция образования сложного эфира (ДГТ) при взаимодействии кислоты (ТФК) и спирта (ЭГ):
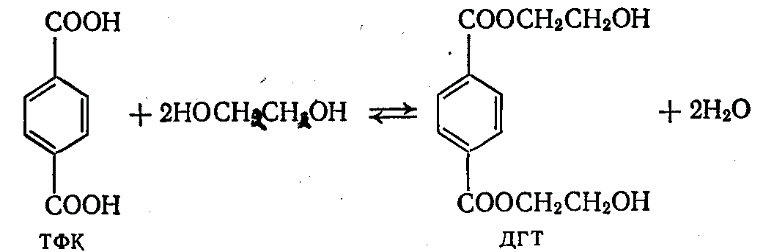
Находит всё большее применение, т.к.:
- уменьшается вредность (нет метанола);
- снижается взрывоопасность, стоимость;
- повышается скорость реакции.
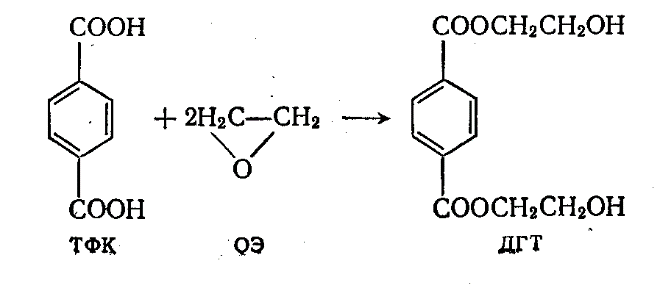
3.3 Окисиэтилирование терефталевой кислоты
Не сопровождается выделением побочных продуктов, обратима. Проводят в водной или органической среде в присутствии катализаторов. Условия проведения процесса: температура 90-130оС, давление 2-3 МПа, продолжительность 0,5-4 часа. Процесс представляет интерес при получении неочищенного ДГТ.
Вопросы для закрепления
1. Применение лавсана?
2.Сырье для получения ПЭТ?
3. Промышленные методы получения диэтиленгликольтерефталата?
Дата добавления: 2017-09-19; просмотров: 576;
