Реакции с разрывом связи С-О
1.4.2.1.Реакции с галогеноводородами
Спирты реагируют с галогеноводородами с образованием галогеналканов и воды. Третичные спирты вступают в реакцию легче, чем вторичные, а вторичные легче, чем первичные. Реакция спиртов с галогеноводородами является обратимой. Гидроксил плохо уходящая группа. Обладает низкой поляризуемостью. Для повышения поляризуемости, соответственно, для более легкого разрыва связи С-О действуют кислотами, что приводит к образованию оксониевого иона и легкому отщеплению воды, либо к образованию сложного эфира и также легкому отщеплению кислотного остатка.
Реакцию проводят пропуская газообразный галогеноводород в спирт, или нагревая спирты с концентрированными растворами галогеноводородных кислот. Бромалканы получают нагреванием спиртов (кроме третичных) с бромидом калия или натрия в присутствии серной кислоты:
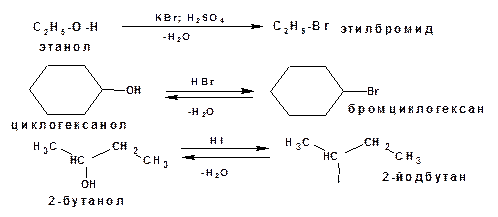
1.4.2.2. Реакции с галогенидами фосфора и серы
Эти реакции являются лучшими методами получения галогенопроизводных из спиртов. Протекают быстро, с высокими выходами, без побочных процессов:
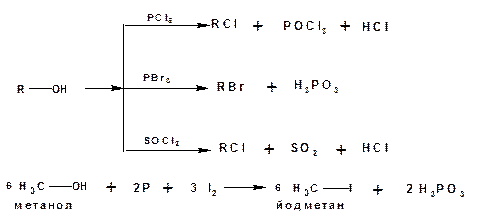
Окисление
В качестве окислителей спиртов могут быть использованы: хромовый ангидрид, хромовая кислота, перманганат калия, двуокись марганца и т.д. Во всех случаях первичные спирты дают альдегиды, а вторичные – кетоны. Кроме того, при пропускании паров первичного или вторичного спирта над медным катализатором при 3000С протекает реакция дегидрогенизации (дегидрирования) спиртов. Также из первичных спиртов получаются альдегиды, а из вторичных – кетоны:
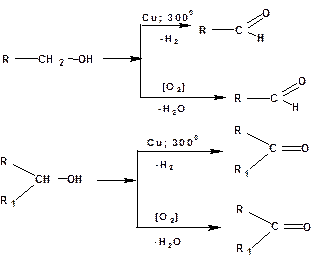
Третичные спирты окисляются трудно, при этом происходит разрыв углерод-углеродных связей и образуется смесь кислот и кетонов.
1.4.4. Восстановление
Спирты устойчивы к действию восстановителей. Они не восстанавливаются водородом над катализаторами. Поэтому спирты используют в качестве растворителей и доноров электронов.
Методы восстановления спиртов основаны на превращении спиртов в соединения другого класса, которые уже легко восстанавливаются. Например:
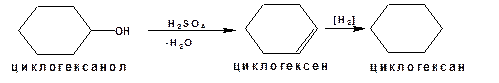
Дата добавления: 2017-08-01; просмотров: 780;
