Кислотно-основные свойства
Спирты являются амфотерными соединениями. Они способны выступать в роли как кислот, так и оснований.
Диссоциацией по связи О-Н, спирты проявляют себя как типичные кислоты Бренстеда:
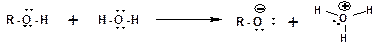
Соответственно спирты способны взаимодействовать со щелочными и щелочноземельными металлами (магний) с замещением атома водорода гидроксильной группы на катион металла. При этом выделяется водород (в момент выделения «in sity» атомарный и поэтому очень активный) и образуется алкоголят:
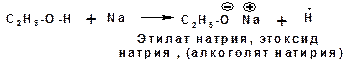
Алкоголяты легко гидролизуются:
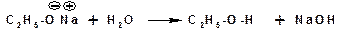
Кислотные свойства спиртов понижаются в ряду метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп, понижающих стабильность аниона.
Свойства оснований спирты проявляют по отношению как к кислотам Бренстеда, так и к кислотам Льюиса. Донорным атомом в молекуле спирта является атом кислорода. Кислоты Бренстеда протонируют атом кислорода гидроксильной группы:
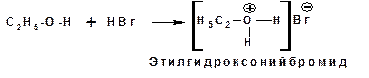
Кислоты Льюиса образуют со спиртами донорно-акцепторные комплексы, в которых атом кислорода выступает в роли донора неподеленной электронной пары:
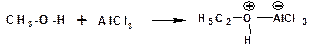
Спирты являются слабыми основаниями. Основные свойства возрастают в ряду: метиловый, первичный, вторичный, третичный, что обусловлено электронодонорными свойствами алкильных групп.
Этерификация
Спирты взаимодействуют с минеральными и органическими кислотами с образованием соответствующих сложных эфиров и воды:
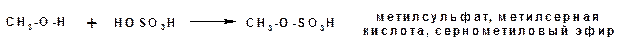
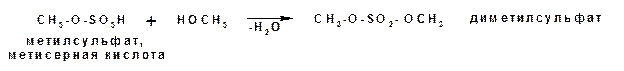
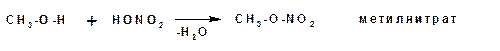
Эфиры неорганических кислот получаются при взаимодействии спиртов и хлорангидридов неорганических кислот:
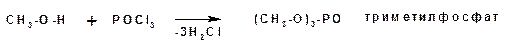
Образование уксусноэтилового эфира:
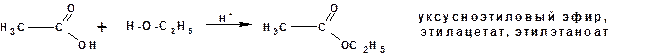
Дегидратация
При действии на спирты водоотнимающих веществ происходит межмолекулярное и внутримолекулярное отщепление воды. Водоотнимающими веществами являются кислоты: серная, фосфорная, щавелевая, беннзолсульфокислота; оксиды металлов: оксид алюминия, оксид тория.
При межмолекулярной дегидратации образуются простые эфиры. Механизм реакции включает две стадии. На первой стадии образуется сложный эфир, который на второй стадии вступает в реакцию нуклеофильного замещения со второй молекулой спирта:
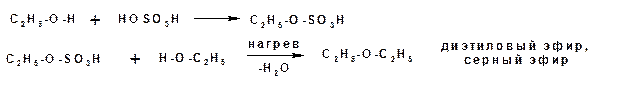
В случае внутримолекулярной дегидратации спиртов, протекающей при более высокой температуре, от сложного эфира минеральнлй кислоты отщепляется кислота с образованием непредельного соединения. В этом случае на второй стадии протекает реакция элиминирования:
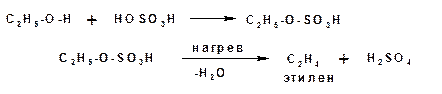
При этом водород отщепляется в соответствии с правилом Зайцева, с образованием наиболее алкилированного олефина.
Эта закономерность в сочетании с правилом Марковникова дает возможность переходить от одних спиртов к другим. Например, от изобутилового к третичному бутиловому спирту:
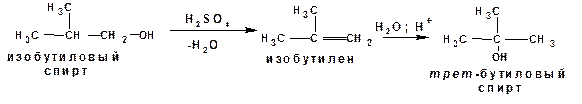
1.4.1.4. Реакции с галогеналканами.
Спирты являются слабыми нуклеофилами поэтому практически не реагируют с галогеналканами. Исключение составляют аллил и бензилгалогениды и некоторые третичные галогенпроизводные. Реакции протекают по механизму SN1.
Алкоксид-анионы являются сильными нуклеофилами и основаниями и способны реагировать с галоидными алкилами по механизму SN2:

Дата добавления: 2017-08-01; просмотров: 479;
