Классическим примером тепловой деструкции белков является переход коллагена в глютин, в результате чего образуется глютин. С этим процессом связано размягчение мяса.
Очень перспективным является использование ферментативной деструкции в технологических процессах. ферментативная деструкция белков в мясе происходит постоянно под действием целой группы собственных протеолитических ферментов и обуславливает процессы созревания мяса в послеубойный период. При этом изменяется консистенция, увеличивается нежность и другие показатели, присущие созревшему мясу.
Ферментативная деструкция белков происходит при искусственном ферментолизе белковых продуктов. На этом основаны технологии сыровяленых колбас, вкусо-ароматических концентратов, имитирующих вкус мясных и рыбных бульонов.
Ферментативная деструкция используется при выделении белковых веществ, очистки их от примесей, для высвобождения их из комплексов.
Контрольные вопросы
1. Дайте общую характеристику белковым веществам.
2. Назовите общие физико-химические свойства, присущие белковым системам.
3. Охарактеризуйте функциональные свойства белков и их значимость в технологических процессах.
4. Основные направления модификации белковых веществ.
5. В каком состоянии находятся белки в пищевых продуктах с различной влажностью?
6. Какие факторы определяют гидратацию белков?
7. От чего зависят денатурационные изменения белка?
Характеристика белков пищевых продуктов
| БЕЛКИ МЯСА |
| Строение мышечной ткани |
Под мясом понимается туша или часть туши, полученная от убоя скота и представляющая собой совокупность мышечной, жировой, соединительной и костной (или без нее) тканей. Преобладающей тканью в мясе является мышечная. Она составляет до 40% массы тела животного, является основой скелетной мускулатуры и наиболее ценной в биологическом отношении.
Мышечная ткань (Рис.2.4.) построена из мышечных волокон – многоядерных клеток толщиной от 10 до 100 микрон и длиной 12 и более сантиметров. Поверхность волокна покрыта эластичной оболочкой – сарколеммой, которая состоит из двух слоев с липидной прослойкой.





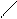

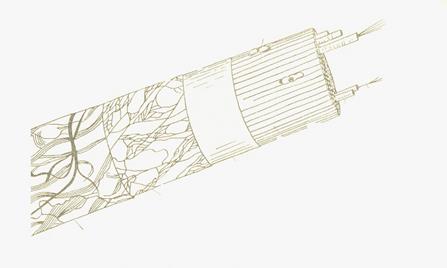
Рис. 2.4. Схема строения мышечного волокна
1- ядро; 2 –миофибрилла; 3- миофиламент; 4 – саркоплазма;
5 – сарколемма; 6 – ретикулиновые волокна; 7 – эндомизиальные коллагеновые и эластиновые волокна
К наружному, гомогенному, слою прикрепляются коллагеновые фибриллы, которые располагаются вокруг волокна в виде сетки. Внутренний слой – это мембрана, внешний – состоит из густой сетки коллагеновых и эластиновых волокон. Посередине волокна расположены продольные структурные элементы миофибриллы, а так же ядра и некоторые органеллы клетки (митохондрии, рибосомы, лизосомы и т.д.). Меньшую часть клетки (40…35% объема) занимает саркоплазма, которая полностью ок  ружает все клеточные образования.
ружает все клеточные образования.
Миофибриллы – это поперечнополтосатые структуры, толщиной 1…2 нм, которые располагаются вдоль мышечного волокна направленными пучками, состоят, в свою очередь, из миофиламентов. Ядра и другие органеллы находятся под сарколеммой на периферии.
Мышечные волокна соединяются с помощью тончайших прослоек соединительной ткани эндомизия в небольшие первичные пучки. Первичные пучки соединяются во вторичные и так далее. Пучки высшего порядка покрыты
| Рис. 2.5. Поперечный срез мышц: 1 – наружная оболочка (эпимизий); 2 – перимизий; 3 – эндомизий; 4 – кровеносный сосуд |
соединительно-тканной оболочкой перимизием и в совокупности составляют мускул, который так же покрыт соединительно-тканной оболочкой эпимизием (Рис.2.5). Эндомизий и перимизий образуют своеобразный каркас, или строму мышц.
Сердечная мышечная ткань состоит из мышечных волокон, взаимосвязанных между собой, волокна содержат много саркоплазмы, богатой гликогеном мало фибрилл, расположенных пучками.
Основой ткани языка служат поперечно-полосатые мышцы, волокна которых проходят пучками в трех взаимно перпендикулярных направлениях. Между пучками расположена в меньшем количестве соединительная ткань и в большем – жировая. На поверхности языка слизистая оболочка тесно связана с мышечной тканью прочной пленкой.
Печень снаружи покрыта соединительно-тканной оболочкой, которая проникает внутрь органа и образует перегородки. Эти перегородки подразделяют печень на дольки, имеющие форму шестигранной призмы размером 1,5-2,5 мм. Соединительной ткани больше всего в печени свиней, ее прослойки хорошо видны и придают продукту «мраморный» вид и крупитчастую структуру.
| Строение соединительной ткани |
Различают несколько разновидностей соединительной ткани: жировая, ретикулярная, плотная, хрящевая, костная, рыхлая.
С технологической точки зрения наиболее интересно строение рыхлой ткани. Так как она обуславливает структурно-механические свойства и консистенцию мяса. Рыхлая ткань прослаивает все органы и ткани и представлена эндомизием, перимизием и эпимизием.
Соединительная ткань по химическому строению существенно отличается от мышечной, содержит меньше воды 58…62%, ее сухой остаток (90%) состоит из белковых веществ, которые принадлежат к группе склеропротеидов – коллагена, эластина и ретикулина, которые образуют плотные и эластичные волокнистые структуры.
Соединительная ткань представляет собой систему, в состав которой входит межклеточное аморфное вещество, тонкие волокна коллагена, эластина и ретикулина и форменные элементы. В рыхлой соединительной ткани межклеточное вещество преобладает, имеет вид студнеобразной массы, которая может связывать большое количество воды. В межклеточном пространстве в виде пучков упорядочено или хаотично (в зависимости от строения) расположены коллагеновые, эластиновые и ретикулиновые волокна. Свойства ткани зависят от соотношения этих волокон.
В состав основного вещества входят специфические белки муцины и мукоиды, которые образуют с мукополисахаридами комплексы, которые удерживают фибриллярные и клеточные компоненты. Мукополисахариды (гиалуроновая кислота, хондроитин, гепаринсульфат и др.) выполняют роль цементирующего компонента основного вещества, а так же принимают участие в образовании межмолекулярных связей пептидных цепей коллагена, эластина и ретикулина.
Основной структурной единицей коллагенового волокна является фибрилла, которая состоит из протофибрилл, которые, в свою очередь, построены из макромолекул. В составе каждой макромолекулы три одинаковых полипептидных цепи, которые спирально закручены вокруг одной оси и состоят из трех аминокислот – глицина, пролина и оксипролина.
С увеличением возраста животных коллагеновые волокна утолщаются за счет цементирующего их основного вещества.
В эндомизии пучки коллагеновых волокон располагаются параллельно, они тонкие, эластиновых волокон очень мало. Строение эндомизия во всех тканях практически одинаково, а перимизия сложнее и неоднородное в различных мышцах. Это обусловлено тем, что в процессе жизнедеятельности животного мышцы выполняют неоднородную по характеру и нагрузке работу. В перимизии волокна толще, содержат больше эластина. В мышцах, которые при жизни животного выполняли тяжелую работу, коллагеновые волокна расположены хаотично и переплетаются.
| Характеристика белков мышечного волокна и соединительной ткани |
Поперечно-полосатая мышечная ткань представляет собой наиболее ценную в пищевом отношении часть мяса, так как является основным источником белка. В мышечной ткани содержится 72…80% воды, 18…22% белков, 2…5% липидов, 1…1,5% углеводов, 1…2% азотистых экстрактивных небелковых веществ и 0,7…1% минеральных веществ.
Белки мышечной ткани в большей степени обуславливают ее биологическую ценность и ее важнейшие свойства.{29}
В состав мышечной ткани входят белки мышечного волокна и белки межклеточной среды. Белки мышечного волокна входят в состав оболочки (сарколеммы), ядер, саркоплазмы, миофибрилл. Находятся они в свободном или в связанном с липидами, катионами или с другими соединениями состоянии. Приблизительно 40% белков мышечной ткани растворены в воде (саркоплазмы и частично миофибрилл), 40% (миофибриллярные) – в солевых растворах хлористого калия. Остальные, нерастворимые, называют строматопротеинами. Белки саркоплазмы и миофибрилл – полноценные, сарколеммы – принадлежат к неполноценным. В соответствии с морфологической структурой мышечного волокна белки распределяются как показано на схеме.
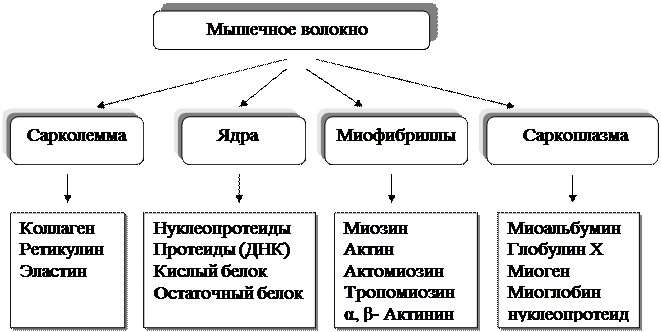
Рис. 2.6. Распределение основных белков
мышечного волокна
Белки сарколеммы составляют приблизительно 4,4…5% общего количества белков клетки. Эластин, коллаген и ретикулин являются основными белками соединительной ткани.{30}
Коллаген - не растворимый в воде белок, в процессе тепловой обработки переходит в глютин, уже хорошо растворимый в воде. Протофибриллы коллагена имеют вид тройной спирали и состоят из глицина, пролина и оксипролина. Коллаген - неполноценный белок, содержит оксипролина больше любого другого белка – 12,8%. Волокна коллагена слабо растянуты. При нагревании в воде при температуре 60…70оС они сокращаются приблизительно на 1/3 или 1/4 от первоначальной длины. При повышении температуры до 80оС коллаген превращается в глютин (желатин), растворимый в воде.{31}
Из протеолитических ферментов на коллаген влияют пепсин и колагеназа, а на механически измельченный еще и трипсин, катепсин и др. Коллаген может удерживать большое количество воды. При рН 5…7 100г коллагена поглощают 200 г воды, при снижении рН в кислую или щелочную сторону количество поглощаемой воды стремительно увеличивается.
Эластин– основной белок эластиновых волокон, не растворяется в процессе нагревания ни в воде, ни в растворах кислот и щелочей, не образует желатин. Это единственный белок, содержащий хлорофорный остаток, что придает ему характерный желтый цвет и определяет его флуоресценцию.{32}
Ретикулин – входит в состав ретикулиновых волокон, которые образуют сетчатые структуры, в которых уложены кровеносные сосуды. По строению похож на коллаген, но не образует желатина в процессе кипячения.
При повышении содержания соединительной ткани снижается биологическая ценность мяса, повышается его жесткость. А усложнение структуры соединительной ткани повышает ее стойкость к тепловой обработке.
Белки ядер - нуклеопротеиды, кислый и остаточный белок.
Нуклеопротеиды – соединения белков гистонов и проламинов, нерастворимые в воде, растворимы в щелочах и растворах хлористого натрия.
Кислый белок – напоминает глобулин, растворим в щелочах
Остаточный белок – по свойствам и аминокислотному составу напоминает коллаген.
Белки миофибрилл – миозин, актин, актомиозин, тропомиозин – составляют примерно 65% внутриклеточных белков, играют важную роль в изменениях мышечной ткани.
Миозин – самый важный белок, на его долю выпадает 35…40% всех мышечных белков. Содержит 20 аминокислот, в том числе все незаменимые, имеет кислый характер. Не растворим в воде, растворяется в солевых растворах, высаливается при полном насыщении хлористым натрием. Владеет свойствами фермента аденазинтрифосфатазы, то есть катализирует расщепление АТФ, в процессе которого освобождается энергия, необходимая для сокращения мышечного волокна.
 АТФ +Н2О АДФ + Н3РО4 + 33,5 кДж/ моль
АТФ +Н2О АДФ + Н3РО4 + 33,5 кДж/ моль
Температура свертывания миозина 45…50оС. Молекула состоит из 5000 аминокислотных остатков.{33}
Актин – 15% общего количества мышечных белков, существует в глобулярной и фибриллярной формах. Состоит из одной цепи, включает 374 аминокислотных остатков. Способен вступать во взаимодействие с миозином, образуя актомиозин. Температура денатурации приблизительно 50оС.{34}
Актомиозин – 3,7% , обладает высокой вязкостью, способен резко сокращаться при определенных концентрациях солей калия или магния, в присутствии АТФ распадается на актин и миозин. Денатурирует при 42…48оС.
Тропомиозин – подобен миозину, но, в отличие от него, является неполноценным белком (отсутствует триптофан). При рН 7 хорошо ратворяется в воде, не денатурирует под влиянием нагрева.{35}
Белки саркоплазмы - миоглобулин, глобулин Х, миоген, миоглобин и нуклеопротеиды – составляют 32…37% внутриклеточных белков
Миоальбумин – 1…2% является типичным альбумином, температура денатурации 45…47оС
ГлобулинХ – 20% всех белков – включает ряд белков, которые являются типичными глобулинами, некоторые проявляют свойство ферментов. Коагулирует при 50оС.
Миоген – 20% - растворим в воде, не полностью высаливается хлористым натрием, температура коагуляции 55…65оС. Так же является смесью белковых соединений, некоторые из которых обладают ферментативными свойствами, ускоряя превращения углеводов и других соединений.
Нуклеопротеиды являются сложными белками, состоят из РНК и белкового компонента
Миоглобин – 0,1…1%, принадлежит к дыхательным белкам, действует как промежуточный переносчик кислорода от гемоглобина крови к окислительным участкам клеток. Принадлежит к хромопротеидам, состоят из белка и глобинового компонента гема, в состав которого входит двухвалентное железо. Это неполноценный белок, так как отсутствует изолейцин, цистин, цистеин. Способен вступать в реакцию с кислородом воздуха, окисом азота, восстанавливаться, действовать как пероксидаза, каталаза, оксидаза.{36}
Миоглобин имеет темно красный цвет, обуславливает природную окраску мышечного волокна. Цвет мяса зависит от концентрации миоглобина, степени связывания кислорода миоглобином, величины заряда железа в геме (двух- или трехвалентное). Так мясо кита содержит 0,91% миоглобина, конина – 0,8%, говядина – 0,6%, свинина - 0,06%.
| Изменение структуры и свойств белков мяса в процессе тепловой обработки |
| Изменение белков мышечного волокна |
Ранее отмечалось, что белки мышечной ткани характеризуются неодинаковой температурой денатурации. Основные денатурационные процессы происходят в интервале температур 57…75оС. При этом обязательным является наличие воды. Про ход денатурации свидетельствует изменение растворимости и ферментативной активности.{37}
Денатурационные изменения начинаются уже при 30оС – это относится к миозину. В интервале 40…50оС происходят наиболее значительные изменения. При 55оС уплотняется сетка белковой структуры. При 65…70оС денатурация белков миофибрилл заканчивается. Белки саркоплазмы большей частью денатурируют до 50оС. Изменения цвета мяса происходят в интервале температур 70…80оС, когда происходит денатурация миоглобина, в результате чего отщепляется гем от глобина.
Белковые вещества в мышечной ткани связаны друг с другом и другими веществами, поэтому денатурируют медленнее и при более высоких температурах, чем изолированные. Денатурация мышечных белков приводит к снижению гидратации мышечной ткани, агрегированию белковых частиц и свертыванию белка. Так как температура нагрева продукта всегда превышает температуру денатурации, ткань уплотняется, часть воды выделяется в окружающую среду.
| Денатурация и деструкция коллагена |
Консистенция готового к употреблению мясопродукта обусловлена степенью разрушения ее соединительно тканных прослоек. Решающее значение играет изменение коллагена, так как эластин при тепловой обработке практически не изменяется.
В процессе нагрева коллагена идет плавление полипептидных цепочек и разрыв связей между цепочками. Денатурация (или сваривание) коллагена сопровождается нарушением специфической конфигурации цепочек и молекулы в целом. При 50…55оС коллагеновые волокна набухают, поглощая воду, при 58…62оС резко сокращается длина волокна (на 60%) и увеличивается его диаметр. Коллаген различных видов мяса имеет неодинаковую температуру денатурации 55…65оС, которая зависит от возраста животного. Фибриллярная структура разрушается, волокна становятся стекловидными, более эластичными, их прочность снижается.
Изменения размера коллагеновых волокон приводит к деформации кусочков мяса. Характер деформации зависит от сложности строения перимизия. Но температура обработки мяса значительно превышает верхнюю границу температуры денатурации коллагена. После 80оС значительно изменяются его свойства и строение. Ускоряется разрыв водородных связей и солевых мостиков, что приводит к деструкции коллагена с образованием глютина. Молекула глютина состоит из 5 – 6 связанных цепей, имеет значительно меньшую молекулярную массу. Образовавшийся глютин, в отличие от коллагена, при температуре более 40оС хорошо набухает и неограниченно растворяется в воде. Полный гидролиз коллагена происходит в процессе нагрева при 126оС на протяжении 3 часов.
Растворы глютина при охлаждении образуют студни, прочность которых зависит от концентрации глютина и продолжительности нагрева. Студни при концентрации глютина более 2,5% хорошо сохраняют форму. При дальнейшем нагреве студнеобразующая способность глютина снижается из-за его разрушения. Деструкция коллагена является основной причиной размягчения мяса. В мясе, доведенном до готовности, весь коллаген денатурировал, а часть его перешла в глютин. В среднем в глютин переходит 20…45% коллагена, что обусловлено видом мяса, содержанием и строением соединительной ткани. Излишний распад коллагена приводи к нарушению формы продукта и трудности его порционирования.
На скорость перехода коллагена в глютин влияют следующие технологические факторы:
а) температура среды; при жарке мясопродуктов, когда температура в толще продукта не превышает 80…85оС, переход коллагена в глютин протекает медленно; поэтому тепловая обработка методом жарки возможна только для тех кулинарных частей, в которых коллагена содержится сравнительно мало и морфологическое строение соединительной ткани простое; коллаген рыб подвергается деструкции значительно легче, чем мяса, поскольку имеет более простое строение, в составе его меньше оксипролина, он подвергается деструкции при более низких температурах;
б) реакция среды; подкисление среды пищевыми кислотами ускоряет переход коллагена в глютин;
в) измельчение мяса способствует снижению гидротермической устойчивости коллагена.
Деструкция коллагена до глютина ускоряется и в щелочной среде. Это используется в мясной промышленности для выработки желатина, который представляет собой высушенный глютин.
| БЕЛКИ МОЛОКА |
Молоко – это полидисперсная система, дисперсной средой которой является водная фаза, дисперсионной фазой - минеральные соли, лактоза, белки, фосфат кальция и жир.
Под влиянием различных технологических факторов происходят изменения как состава, так и свойств составных частей молока. Высокая пищевая ценность молока обусловлена оптимальным содержанием в нем белков (2,9…3,5%), жиров (3,5…6%), углеводов (5%), минеральных солей и витаминов, а так же практически идеальным их соотношением. Отдельно нужно выделить биологическую ценность белков молока, которые отличаются сбалансированностью незаменимых аминокислот, их хорошим перевариванием и усвояемостью организмом. Аминокислотный скор коровьего молока составляет 95%. Белки особенно богаты лизином и треонином, лимитированными являются метионин и цистин.{38}
В настоящее время в молоке выделяют две группы белков, которые имеют различные свойства: казеин и сывороточные белки.{39}
Казеин, на долю которого приходится 78…85% белков молока, находятся в виде коллоидных частиц или мицелл, тогда как сывороточные белки остаются в молочной сыворотке в растворенном состоянии.
Казеиновая фракция представлена α, β, γ, κ – казеинам, основные – α и β – составляют 85%.{40}
Сывороточные белки:
β – лактоглобулин – 15…22%
α – лактоальбумин – 7…12%
Альбумин
Иммуноглобулин
Протеозо-пептоны.
Эти фракции отличаются молекулярной массой, изоэлектрической точкой, соотношением аминокислот, особенностями состава и строения.{41}
Сывороточные белки простые (протеины), казеин – сложный белок, в его состав входит фосфорная кислота. Белки молока – это глобулярные белки, имеющие большую молекулярную массу.
Основной белок – казеин. Выделенный и очищенный казеин – это амфотерный порошок, который не растворяется в воде, растворяется в слабых растворах щелочей, кислот, не имеет вкуса, запаха, имеет белый цвет. В молекуле казеина карбоксильные группы доминируют над аминными, поэтому он имеет кислую реакцию. Карбоксильные группы казеина могут реагировать с альдегидными группами лактозы и ионами металлов, образуя казеинаты.
Стойкость казеиновых мицелл в молоке обусловлена наличием гидратной оболочки вокруг нее. Казеин в молоке находится в виде кальций-фосфат-казеинового каомплекса, в котором главная роль принадлежит Са, который образует кальциевые мостики между казеинатами кальция.{42}
Мицеллы казеина стойкие к нагреванию и механической обработке, стабильность их зависит от содержания растворенных солей кальция, химического состава казеина, активной кислотности.
В свежем молоке при рН 6,6 казеин имеет отрицательный заряд. В изоэлектрической точке рН 4,6…4,7 казеин электронейтральный, имеет наименьшую растворимость и коагулирует. На этом базируется принцип приготовления всех видов кисломолочной продукции.
Комплекс белков, который остается в сыворотке после выделения казеина, называют сывороточными. Различают два основных типа молочной сыворотки: сладкую, образующуюся при производтве сыров, и кислую, получаемую при осаждении творога и казеина. β – лактоглобулин в процессе нагревания молока до 85…100оС весь коагулирует, с солями кальция образует молочный камень. В нагретом молоке вместе с к-казеином образует комплексы и выпадает в осадок.{43}
α – лактоальбумин сильно гидратирован, не коагулирует ни в изоэлектрической точке, ни под действием сычужного фермента.
Тепловая денатурация сывороточных белков молока проявляется в снижении их растворимости, освобождении активных сульфгидрильных групп аминокислот. Казеин, в отличие от сывороточных белков, имеет значительно большую термостойкость, выдерживает нагрев до 150…160оС без явных признаков коагуляции. С повышением кислотности казеиновый комплекс коагулирует при более низких температурах. Молоко с кислотностью 55…60оТ сворачивается при комнатной температуре.
К функциональным свойствам молока необходимо отнести их способность эмульгировать жир, стабилизировать жировую эмульсию, повышать водосвязывающую и водопоглощающую способность, образовывать мелко-пористые пены.
| Белки куриного яйца |
Яйца принадлежат к широко используемым в технологическом процессе производства кулинарной продукции. Высокие функциональные (пенообразующая, эмульгирующая, студнеобразующая, стабилизирующая) и технологические (высокое сродство с другими продуктами, хороший вкус, цвет, консистенция) свойства, а также пищевая ценность яиц позволяют использовать их и как активный компонент технологического процесса, и как рецептурный компонент пищи. Большинство этих свойств возможны благодаря уникальным свойствам их белков.
В курином белке содержится 11…12% белков, в желтке – 15…16%. В основном это сложный комплекс различных белковых веществ. Белки полноценны, соотношение аминокислот близко к оптимальному.{44}
В белкеяйца содержится:
Овоальбумины – 60…70%
Овомукоид - 10…14%
Кональбумин - 10…15%
Авидин - 0,05…1%
Лизоцим – 3%
Овоглобулин и др.
В желтке яйца содержатся в основном фосфопротеиды:
Вителлин
Ливетин
Фосвитин
Белки яиц представляют собой концентрированные золи, которые при тепловой обработке коагулируют, превращаясь в гели, удерживающие всю воду. Процесс загустевания белка протекает следующим образом:
45…50оС – изменений не наблюдается
50…55оС – появляются местные помутнения
55…60оС – помутнения распространяются на весь белок
60…65оС – белок заметно густеет
65…70оС – образуется студнеобразная нежная масса
75…85оС – образуется студень, удерживающий воду
85…95оС – студень постепенно уплотняется
Желток начинает загустевать при температуре 70оС, что позволяет сварить яйца в «мешочек», яичницу глазунью. В смеси с молоком образуется менее плотный студень – омлеты, яичные кашки. Но при этом жидкости не должно быть более 50…60%. {45}
Поваренная соль снижает температуру денатурации белков, поэтому при попадании соли на желток в процессе жарки на яичницы образуются белые пятна свернувшегося белка. Рекомендуется солить или белок, или жир.
Авидин и овомукоид в нативном состоянии отрицательно влияют на процесс пищеварения. Авидин в кишечнике связывает биотин (витамин Н), который участвует в регуляции нервной системы. Овомукоид угнетает действие трипсина, поэтому белки сырого яйца не только плохо перевариваются, но и частично всасываются в непереваренном виде, что может вызвать аллергию, при этом ухудшается усвоение соединений кальция. Поэтому рекомендуется употреблять термообработанные яйца, когда овомукоид денатурирует и потеряет свои свойства.
В яйцах содержится 1,6% холестерина, а так же высокоактивная арахидоновая кислота, нормализующая жировой и холестериновый обмен. Липиды яиц содержат олеиновую, арахидоновую, линолевую и другие кислоты, до 9% фосфатидов. Снижения усвояемости яиц после тепловой обработки не отмечается.
| Белки зерномучных продуктов |
Мука, вырабатываемая мукомольной промышленностью, характеризуется определенными свойствами и химическим составом, поскольку в процессе ее выработки в конечный продукт поступают различные анатомические части зерна в неодинаковом соотношении.
В клетках паренхимной ткани семядолей бобовых и эндосперма семян зерновых и крупяных культур белковые вещества располагаются между крахмальными зернами в виде мельчайших частиц высохшей протоплазмы и алейроновых зерен. Белковые вещества зернобобовых можно разделить на четыре группы:
Альбумины – растворимые в воде
глобулины - растворимые в солевых растворах
глиадин – растворим в спирте определенной концентрации
глютенин – растворим в щелочах
Глиадин и глютенин называют клейковинными белками, так как они составляют основную часть отмытой клейковины теста. Пшеничная мука 1 сорта содержит в среднем 10…12% белковых веществ, при этом глиадин и глютенин составляют не менее 80% общего количества белков муки. В бобовых, крупах и муке белки находятся в состоянии сухих бесструктурных гелей.
Набухание зерновых продуктов при замачивании, так же как и образование эластичного теста при замесе муки, обуславливается набуханием содержащихся в них белков, которые превращаются в более или менее обводненные гели. Вода, поглощаемая белками при набухании, связывается или адсорбируется осмотически и составляет около 200% их количества.
Количество альбуминов и глобулинов составляет 15…20% общего содержания белков пшеницы. Отличаются от клейковинных белков более высоким содержанием лизина. В свободном состоянии в муке содержатся все аминокислоты, обнаруженные в пшенице и ржи, хотя количество их незначительно.
Контрольные вопросы
1. Строение тканей теплокровных животных.
2. Характеристика белков мышечной соединительной ткани.
3. Изменения белков мышечной и соединительной ткани в процессе тепловой кулинарной обработки мясопродуктов.
4. Характеристика белков молока, яиц и зернобобовых.
5. Характеристика технологических свойств белков растительных продуктов.
6. Характеристика технологических свойств белков молока и яиц.
Дата добавления: 2017-06-02; просмотров: 1772;
