Сорбционные методы в биотехнологии
Сорбционные методы представляют собой выделение растворенного в жидкой фазе компонента с помощью твердофазного сорбента. В какой-то мере этот процесс является по смыслу противоположным экстрагированию, где, наоборот, полезный компонент локализован в твердой фазе, а в процессе экстракции переходит в жидкую (экстрагент). При сорбции же растворенное вещество из раствора переводится в твердую фазу (сорбент). На этом, однако, сорбционный метод не заканчивается. Далее следует отделение твердой фазы от рафината - раствора, из которого извлечен растворенный компонент, и последующая десорбция этого компонента из сорбента в новую жидкость, отличающуюся от исходного раствора какими-то свойствами или просто более чистую, не содержащую посторонних примесей, которые есть в исходном растворе. Эта вторая операция (десорбция) уже точно практически ничем не отличается от экстрагирования, разве что при экстрагировании твердой фазой является сама биомасса, а при десорбции - промежуточный рабочий агент, специально вносимый в жидкую фазу извне. Твердая фаза - «временное пристанище» растворенного вещества.
Известны четыре различные модификации сорбционных методов:
- ионный обмен;
- адсорбция микропористыми сорбентами;
- хроматография;
- биосорбция.
Во всех случаях подразумевается, что сорбционный метод включает в себя как собственно сорбцию, так и десорбцию, и рассматривается метод выделения как совокупность этих двух процессов.
Ионный обмен
Ионообменный метод основан на способности специальных сорбентов - ионообменных смол - сорбировать биологически активные вещества, имеющие ионную природу (т. е. являющиеся кислотой, основанием или солью), благодаря эквивалентному обмену между ионами вещества, находящегося в растворе, и ионами сорбента. Ионообменные смолы, или иониты, представляют собой синтетические высокомолекулярные органические вещества, практически нерастворимые в воде. Они содержат обменные ионы, один из которых связан с твердым носителем и называется фиксированным, или анкерным ионом. С ним электростатически связан противоположно заряженный ион, называемый подвижным ионом, или противоионом. По этому подвижному иону ионообменные смолы подразделяются на катионообменники и анионообменники:
Тв. - Н+ (катионообменник);
Тв.. – OH- или Тв. – Cl‑ (анионообменник).
Кроме того, существуют и амфотерные иониты, которые содержат и катионо- и анионообменные группы, обладая, таким образом, двойственными свойствами.
Процесс ионного обмена имеет обратимый характер и протекает следующим образом:
| Тв-Н+ | + | (растворенный ион)+ | « | Тв-(растворенный ион)+ | + | Н+ |
| ионит | Ионит, сорбировавший растворенный ион |
Высвобождающийся противоион диффундирует далее через поры ионита в жидкость. Движение ионов растворенного вещества внутрь гранулы ионита и, наоборот, вывод противоионов в окружающую жидкость происходят за счет диффузии. Как и в любом массообменном процессе, в какой-то момент наступает равновесие между скоростями сорбции и десорбции.
Для твердой фазы в условиях сорбции существует определенная особенность. Количество активных центров ионообменника ограничено (числом анкерных ионов), в связи с этим максимальное количество ионов растворенного вещества, связанных ионитом (т. е. сорбированных), не может быть больше определенного предела. Поэтому связь между равновесными концентрациями растворенного вещества в жидкости и в ионообменной смоле определяется соотношением, называемым изотермой Ленгмюра:
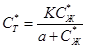
где CТ* и СЖ* - соответственно равновесные концентрации растворенного иона в твердой фазе (сорбента) и в жидкости (рафинате); К и а - константы, зависящие от свойств продукта и от свойств ионита соответственно.
Основной характеристикой обменной способности ионита является полная обменная емкость (ПОЕ). Она определяется как число обменных групп в мг-эквивалентах, приходящееся на 1 г ионита. Практически это и есть К, выраженное в мг-эквивалентах растворенного вещества:
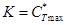
Не надо забывать, что связь, определяемая изотермой Ленгмюра, характеризует условия равновесия. В реальном же процессе, пока идет насыщение ионообменной смолы ионами растворенного вещества, текущая концентрация СТ в сорбенте отличается от равновесной. Движущей силой процесса массопередачи как раз и является разность между равновесной концентрацией СТ* (определяемой по изотерме Ленгмюра или по коэффициенту распределения, если концентрация находится в зоне малых значений) и текущей концентрацией Ст:
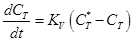
Где KV - объемный коэффициент массоотдачи между жидкостью и ионитом, учитывающий, в частности, и концентрацию гранул ионита в системе, и поверхность массообмена в каждой грануле, и истинный коэффициент массоотдачи растворенного вещества; СТ* - концентрация, равновесная с той, которая есть в жидкости, Сж.
В зависимости от знака выражения в скобках (СТ* - CТ) будет происходить либо процесс сорбции (концентрация СТ во времени будет возрастать), либо процесс десорбции (концентрация СТ падает).
На практике при десорбции несколько изменяется рабочая жидкость, для нее может быть своя изотерма Ленгмюра и свой коэффициент распределения. Сорбция же обычно осуществляется до тех пор, пока вся обменная емкость ионита не будет заполнена (т.е. пока концентрация СТ* не достигнет величины К). Кстати, в процессах ионообмена процесс десорбции имеет специфическое название элюция, а десорбирующая жидкость называется элюентом.
Как на практике осуществляется процесс ионного обмена?
Наиболее прост статический способ. В аппарат с мешалкой загружают ионит и обрабатываемый раствор. Затем при перемешивании ионит суспендируется и дается время, достаточное для установления равновесия. Далее раствор сливают или фильтруют (если гранулы ионита слишком мелкие). Раствор обычно направляют в канализацию (так как он обеднен по целевому продукту) или повторно используют на стадии ферментации. Ионит же возвращают в аппарат, заливают элюентом, т.е. водным раствором, часто с измененным значением рН или с добавлением противоиона (иона хлора). Происходит обратный процесс (десорбция, элюция) – противоион сорбируется в ионите, а сорбированное ранее вещество переходит в элюент. При этом продукт освобождается от примесей, которые не сорбируются и уходят с исходным раствором. Однократная сорбция-десорбция имеет недостаток: при этом сорбент не полностью поглощает растворенное вещество и не полностью переходит в элюент. Поэтому процесс иногда повторяют. Чаще же в промышленности используют динамический способ. В этом способе ионит загружается в аппарат и обрабатываемый раствор непрерывно протекает через слой ионита. Назвать этот процесс полностью непрерывным нельзя, так как ионит загружается и выгружается периодически, поэтому процесс нестационарный. Аппарат с загруженным ионитом называется ионитовым фильтром, или ионообменной колонной. Возможны два варианта таких «фильтров»: закрытый (напорный) и открытый (безнапорный).
Закрытый фильтр представляет собой колонну, заполненную гранулами ионита. Жидкость подается под напором сверху. У днища внутри аппарата устанавливается колпачковый фильтр с прорезями 0,2 - 0‚3 мм, через которые проходит жидкость, но задерживаются гранулы ионита. Недостатком такой простой конструкции является неподвижность слоя ионитов, который сжат давлением нагнетаемой жидкости. Происходит слипание частиц ионита, образование каналов и застойных зон. В результате довольно большая часть ионита не участвует в процессе ионообмена, возможно также инфицирование застойных участков посторонней микрофлорой.
В открытый фильтрраствор подается снизу через специальный слой зернистого материала. Скорость потока в аппарате выбирается таким образом, чтобы слой ионита находился во взвешенном состоянии. Чтобы при этом не происходило выноса гранул ионита, верхняя часть колонны выполнена расширенной. В этой части колонны скорость потока снижается, что способствует оседанию гранул. Вывод отработанного раствора из колонны снабжен системой улавливания гранул (за счет изменения направления потока). В обоих случаях после насыщения слоя ионита (определяемого по повышению концентрации растворенного вещества в отработанном растворе) раствор переключается на другую колонну, затем на третью, четвертую и т. д. Обычно существует батарея ионообменных колонн, работающих в различных режимах. На отключенной колонне сначала проводят вытеснение рабочего раствора обессоленной водой, затем промывают ионит раствором антисептика. Далее осуществляется процесс извлечения полезного вещества из сорбента - элюция. Элюат (чистый раствор, содержащий десорбированное вещество) поступает на дальнейшие стадии концентрирования. Элюция прекращается после снижения концентрации в выходном потоке до предельного уровня. После элюции проводится процесс регенерации ионита. Для этого через слой ионита пропускают раствор противоиона, который сорбируется на ионите, занимая там свое «законное место».
Поскольку в рассмотренной схеме слой ионита остается неподвижным, приходится иметь батареи аппаратов, постепенно переключая их на тот или иной режим работы. Обычно количество элюата меньше, чем количество исходного раствора, что позволяет наряду с очисткой вещества от примесей проводить частичное концентрирование раствора.
Ионообменным способом выделяют многие антибиотики, аминокислоты, ферменты. Несколько слов о самих ионообменных смолах. Есть много типов ионитов, имеющих размеры гранул от 300 мкм до 2 мм и более. При этом очень важен их равномерный дисперсный состав (чтобы не было уноса). Иногда делают смолы с непористым внутренним ядром, внешний слой смолы занимает лишь 30 - 50 мкм, что способствует более быстрой сорбции - десорбции. В качестве матриц в смолах используют:
- полистирол (поливинилбензол);
- полиакрилат, полиметакрилат;
- полиамин;
- целлюлозу, декстран и др.
В качестве функциональных групп применяются: карбоксильные, сульфоновые, первичные - четвертичные аминогруппы.
Преимущества метода:
- простота аппаратурного оформления;
- многократное использование ионообменных смол;
- возможность полной механизации и автоматизации процесса;
- протекание процесса в водных растворах, без использования вредных органических растворителей.
Недостатки метода:
- нельзя использовать для извлечения неполярных веществ;
- селективность метода не всегда достаточна для разделения смеси веществ;
- наличие твердой фазы затрудняет возможность использования противотока для создания равномерной движущей силы процесса;
- довольно велико гидравлическое сопротивление колонн при малых размерах гранул ионита.
Дата добавления: 2017-03-29; просмотров: 3556;
