Лекция 17. Электролиз в металлургии благородных металлов
Благородные металлы давно являются мировым эквивалентом стоимости вследствие малого содержания в земной коре и трудной добычи, а также высокой стойкости против коррозионного разрушения. За последнее время эти металлы приобретают все большее значение и в технике.
Благородные металлы встречаются в виде самородков (особенно золото и платина) и в разнообразных минералах. Наиболее распространенным минералом серебра является аргентит Ag2S, сопровождающий руды свинца, цинка и меди.
Благородные металлы добывают как из побочных продуктов при извлечении других металлов, так и из собственных самородных и рудных месторождений. Основное количество золота извлекают из самородных россыпей. Главным источником серебра и платиновых металлов, наоборот, являются побочные продукты металлургии меди, никеля, свинца и др. Добыча благородных металлов из россыпей и руд – большая и сложная область гидрометаллургии.
Основным назначением электролиза в металлургии благородных металлов является их рафинирование от загрязнений другими металлами, оставшимися от огневого рафинирования, и отделение друг от друга.
Серебро. По своим электрохимическим свойствам серебро относится к группе металлов с очень низким перенапряжением разряда и ионизации металла. В связи с этим трудно получить плотные катодные осадки серебра из его простых солей: оно выделяется в виде дендритов, губки, игл, но с высоким выходом по току. Из-за малого перенапряжения при не слишком высоких плотностях тока реакции растворения и разряда серебра протекают при потенциалах, близких к равновесному. Возможные примеси – золото, платиноиды, медь, сурьма, висмут, олово, селен и незначительные количества цинка, кадмия, никеля, железа – ведут себя в соответствии с их потенциалами и химическими свойствами. Контролирующей примесью является медь, допустимое содержание которой составляет 30 – 40 г/л. При превышении этого количества часть электролита отбирают и заменяют свежим: серебро из отработанного раствора извлекают методом цементации медью.
Технология рафинирования серебра заключается в следующем: из рафинируемого сплава изготовляют аноды, которые направляют для извлечения содержащегося в нем золота или серебра. Для получения серебра применяют сплавы, содержащие не менее 65% серебра (650 проба). Электролитом служит раствор нитрата серебра концентрацией 25 – 40 г/л, к которому для повышения электропроводимости добавляют до 10 г/л HNO3. При большем содержании кислоты на катоде усиливается реакция восстановления NO3- до NO2-, что снижает катодный выход серебра по току и способствует загрязнению воздуха оксидами азота. Низкое допустимое содержание свободной кислоты является причиной сравнительно высокого напряжения на ванне (1,5 – 2 В).
Выбор плотности тока определяется не катодным, а анодным процессом, так как серебро выделяется на катоде при всех условиях в виде неплотного рыхлого осадка. Анодное растворение, наоборот, зависит от плотности тока на аноде. При наличии в рафинируемом серебре платиноидов повышенная анодная плотность тока может вызвать их растворение (  = + 0,799 В и
= + 0,799 В и 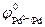 = +0,987 В) и осаждение на катоде при потенциалах ниже потенциалов осаждения серебра. При этом платиновые металлы теряются, а чистота катодного серебра снижается. Анодная плотность тока колеблется в пределах 80 – 100 А/м2 ((0,8 – 1)×10-2 А/см2).
= +0,987 В) и осаждение на катоде при потенциалах ниже потенциалов осаждения серебра. При этом платиновые металлы теряются, а чистота катодного серебра снижается. Анодная плотность тока колеблется в пределах 80 – 100 А/м2 ((0,8 – 1)×10-2 А/см2).
Анодный шлам от рафинирования металла содержит кроме 30 – 70% серебра значительные количества золота и иногда платиноиды. Серебро отделяют растворением его в азотной кислоте, а остаток сплавляют, отливают и в виде анодов направляют на рафинирование золота.
В некоторых случаях производится рафинирование вторичного серебра (дельное серебро), представляющего собой двойные сплавы серебра с медью или же тройные сплавы с золотом и медью.
Рафинирование серебра обычно ведут в ваннах из керамики или другого инертного материала (пластмасса, эбонит) емкостью до 0,5 м3. Выход по току при рафинировании серебра достигает 95 – 97%, расход энергии 300 – 400 кВт·ч/т серебра, чистота катодного серебра 99,95%.
Золото. В отличие от серебра золото образует стойкие одно- и трехвалентные соединения, причем последние более устойчивы. Значения стандартных потенциалов близки: 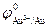 = +1,50 В,
= +1,50 В, 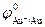 = +1,58 В, поэтому при электрохимическом растворении и осаждении золота из простых растворов происходит образование и восстановление обоих видов ионов. Преобладание участия того или иного иона в анодном и катодном процессах будет зависеть от состава раствора, растворимости солей и параметров электролиза.
= +1,58 В, поэтому при электрохимическом растворении и осаждении золота из простых растворов происходит образование и восстановление обоих видов ионов. Преобладание участия того или иного иона в анодном и катодном процессах будет зависеть от состава раствора, растворимости солей и параметров электролиза.
Важным свойством золота для процессов электролиза является склонность его к пассивированию и комплексообразованию. Из всех возможных соединений золота лучшей растворимостью обладает AuCl3, который и применяется для рафинирования золота.
При взаимодействии AuCl3 с водой образуется комплекс H2[AuCl3O]. Ион [AuCl3O]- и принимает участие в анодном процессе:
H2[AuCl3O] → AuCl3 + 2H+ + 0,5O2 + 2 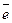
Накопление AuCl3 у анода приводит к его пассивированию, которое уменьшают введением HCl:
AuCl3 + HCl → H[AuCl4] H2[AuCl3O] + HCl → H[AuCl4] + H2O
В рафинируемом золоте, каким бы путем его ни получали, содержится серебро (иногда до 20%), платиноиды (до 50%), медь, свинец и др. Потенциалы металлов анода в водном кислом растворе хлорида следующие:
j0, В j0, В
AuCl4-/Au +0,90 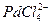 /Pd +0,62
/Pd +0,62
AuCl2-/Au +1,04 Ag+/Ag +0,799
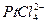 /Pt +0,79 Cu2+/Cu +0,347
/Pt +0,79 Cu2+/Cu +0,347
Из приведенных данных следует, что все примеси в аноде должны растворяться легче, чем золото, поэтому они будут накапливаться в электролите и осаждаться на катоде вместе с золотом по достижении критических концентраций: для платины – 50 – 60 г/л, для палладия – 15 г/л и для меди – 150 г/л.
В процессе рафинирования золота, содержащего серебро, характерно поведение последнего. В хлоридном растворе серебро образует нерастворимый хлорид, который частично переходит в шлам, а частично оседает на аноде, пассивируя его. Для устранения пассивирования золотого анода, содержащего серебро, применяют наложение переменного тока на постоянный. Благодаря этому на золоте чередуются анодная и кратковременная катодная поляризации. В период катодной поляризации серебро из пленки AgCl частично восстанавливается до металла. Часть пленки срывается вследствие изменения знака заряда электрода и поверхностного натяжения. В связи с этим анод активируется и его растворение протекает нормально.
Из приведенных выше значений потенциалов следует, что растворение золотого анода протекает с образованием ионов обеих валентностей, поэтому анодный выход золота по току, рассчитанный только с учетом Au2+, равен 125 – 140 %.
Одновременно и на катоде происходит разряд ионов обеих валентностей. Выход золота по току на катоде из расчета на Au3+ ниже (до 115%). Таким образом, скорость образования AuCl2- количественно больше скорости его разряда и одновалентное золото накапливается в электролите. Это способствует протеканию реакции, характерной для положительных металлов (Cu, Au)
3Au+ 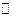 2Au + Au3+
2Au + Au3+
в результате, которой выпадает металлическое порошкообразное золото, теряемое со шламом.
Электролитическое рафинирование золота постоянным током производится в растворах, содержащих 30 – 40 г/л Au3+ и 30 – 40 г/л свободной соляной кислоты, если содержание серебра менее 4%. При более высоком содержании серебра концентрацию ионов золота в электролите принимают равной 60 – 70 г/л Au3+ и 60 – 70 г/л НCl и на постоянный ток накладывают переменный. Рафинирование происходит при 60 – 70°С и высоких плотностях тока: для постоянного тока 500 – 1500 А/дм2(5 – 15 А/см2), а при наложении переменного тока – 1000 – 3000 А/дм2 (10 – 30 А/см2). В этих условиях получают плотный катодный осадок, поэтому катоды изготовляют из жести чистого золота. Чистота золота при рафинировании достигает не менее 99,99% Au.
Объем электролизеров не более 20 – 30 л. Их изготовляют из фарфора с наружным термостатирующим сосудом для нагревания.
Вопросы для самопроверки, задачи и упражнения
Вопросы для самопроверки к лекции 1.
- В чем преимущество использования батарей первичных элементов ХИТ, последовательно соединенных друг с другом?
- Назовите электрохимические технологии, в которых используются сепараторы, и в которых они не используются. Чем вызвана необходимость использования сепараторов?
- Известно, что мерой скорости электрохимической реакции является плотность тока. Какими факторами ограничивается использование высоких плотностей тока в электрохимических технологиях?
- Какими факторами ограничивается использование малых межэлектродных зазоров в электрохимических технологиях?
- Покажите разницу между выходом по току, выходом по веществу и коэффициентом использования исходного реагента.
- Каким требованиям должны удовлетворять аноды в электрохимических технологиях, конечный продукт которых производится в катодом процессе?
- В чем преимущества использования пористых электродов в электрохимических технологиях?
- По объему производства и по значимости первое место среди электрохимических производств занимает электрохимическое получение алюминия. Почему алюминий получают из расплавов, а не из растворов? За счет чего можно добиться снижения энергоемкости производства алюминия, составляющей в настоящее время 14 – 16 кВт час / кг?
- Чем обусловлена необходимость использования циркуляции электролита в электрохимических производствах? Назовите все возможные причины.
- Как правило, производительность современных электролизеров на единицу объема или на единицу площади ниже, чем производительность аналогичных по назначению химических реакторов. Объясните, чем это вызвано.
Задачи и упражнения к лекции 2.
- Какой тип распределения тока будет реализован в ячейке с величиной межэлектродного зазора 0,1 мм при плотности тока 100 А/см2, если в качестве электролита использовать раствор NaCl концентрацией 1 М, а зависимость перенапряжения от плотности тока как для катодной, так и анодной электрохимических реакций равны 100 mB/порядок? Подтвердите вывод расчетом. Какие условия должны быть выполнены, чтобы перечисленные выше параметры могли бы быть реализованы на практике?
- В соответствии с уравнением (2.8) повышение плотности тока уменьшает параметр Вагнера и, как следствие, обеспечивает переход к первичному распределению тока, т.е. максимально неравномерному. Чем можно объяснить, что в целом ряде случаев повышение плотности тока не только не уменьшает равномерность распределения скоростей электрохимических реакций, но даже увеличивает ее?
- Будет ли увеличиваться или уменьшаться равномерность распределения скорости осаждения (растворения) при постоянной плотности тока (средней плотности тока) и электролите с постоянной концентрацией, если вместо однородной электродной поверхности будет использована макроскопически неоднородная поверхность с периодической искусственной изоляцией, например, масками? Объясните почему.
- Рассчитайте величину рассеивающей способности электролита, определяемой в ячейке Хулла с вращающимся цилиндрическим электродом, если при общей высоте цилиндрического электрода 20 см, были экспериментально обнаружены следующие толщины электроосажденых слоев (см. рис. 2.3):
| Расстояние от нижнего края цилиндрического электрода, см | 7,5 | |||||||||||||||||
| Толщина электроосажденного слоя, мкм |
- Постройте графически распределение толщины электроосажденных слоев меди на поверхности вращающегося дискового электрода диаметром 20 см при средней плотности тока 300 А/м2, если осаждение идет в течение 1 часа при 100% выходе по току в расчете на образование Cu(II), а распределение тока является первичным?
- Будет ли уменьшаться или увеличиваться распределение скоростей электроосаждения, если при использовании условий задачи 5 выход по току будет увеличиваться с увеличением плотности тока? Будет оставаться постоянным, но отличным от приведенного в задаче 5?
- Каким будет распределение скоростей процесса электрохимического полирования никеля, если оно осуществляется на поверхности вращающегося цилиндрического электрода?
- Рассчитайте рассеивающую способность электролита хромирования определяемого в ячейке Хулла с вращающимся цилиндрическим электродом при средней плотности тока 0,5 А/см2, если распределение тока в ячейке будет соответствовать тому, что представлено в задаче 4 и будет достигаться следующая зависимость выхода по току хромирования от плотности тока:
| Плотность тока, А/см2 | 0,1 | 0,2 | 0,3 | 0,5 | 0,7 | |
| Выход по току, % |
Вопросы для самопроверки к лекциям 3 – 6.
- Объясните почему ЭДС ХИТ не зависит от межэлектродных расстояний, размеров электродов и других конструкционных параметров ХИТ.
- Назовите все возможные причины, в соответствии с которыми напряжение ХИТ уменьшается с увеличением токовой нагрузки.
- Почему напряжение разряда ХИТ зависит от конструкции, режима разряда, технологических особенностей и других факторов?
- Почему МЦ элементы выгоднее эксплуатировать в прерывистом, а не непрерывном режиме?
- В чем состоят преимущества и недостатки магниевых и литиевых анодов в ХИТ I рода в сравнении с цинковым?
- В чем состоят преимущества ХИТ с твердыми электролитами?
- Рассмотрите уравнения заряда и разряда при работе свинцового аккумулятора и объясните, почему ЭДС свинцового аккумулятора зависит от концентрации серной кислоты.
- Объясните причины «кипения» электролита при зарядке свинцовых аккумуляторов и почему этот фактор может использоваться в качестве индикатора окончания процесса зарядки?
- Перечислите преимущества и недостатки щелочных аккумуляторов в сравнении с кислотными.
- Какими факторами обусловлена поляризация и пассивация железного электрода в никель – железном аккумуляторе?
- Распишите электрохимические анодные реакции, протекающие при работе никель – железных и никель-кадмиевых аккумуляторов и какие процессы могут быть побочными по отношению к токообразующему процессу?
- Перечислите все особенности топливных элементов (ТЭ) как источников энергии и их преимущества в сравнении с другими ХИТ.
- Чем обусловлено применение угольных электродов в качестве электродов в ТЭ? Каковы функции катализаторов при работе ТЭ и какие катализаторы обычно применяются в ТЭ?
- В чем преимущества высокотемпературных ТЭ в сравнении с низко- и среднетемпературными?
- Что представляет собой высокотемпературные топливные элементы регенеративного типа и каков принцип их работы?
Вопросы для самопроверки к лекциям 7 – 8.
1. Объясните, почему для электрохимического получения водорода в качестве электролита используются концентрированные растворы щелочей и железные электроды?
2. Почему выход по току при эдектрохимическом получении водорода из раствора щелочи близок к 100% и какие побочные реакции возможны в этом случае?
3. Чем ограничиваются возможности повышения плотности тока, а, следовательно, единичные мощности электролизеров для получения водорода?
4. На каких принципах основан электрохимический метод получения тяжелой воды?
5. Почему в настоящее время для производства хлора и щелочи используется непрерывная подача электролита в анодное пространство? Какие аноды используются в хлорном электролизе? Опишите их преимущества.
6. В чем преимущества и недостатки получения хлора, каустической соды и щелочи электролизом с ртутным катодом?
7. Почему гипохлорит натрия можно получать бездиафрагменным электролизом?
8. Можно ли и почему получать гипохлорит из морской воды?
Вопросы для самопроверки к лекциям 9 – 12.
1. Что общего и в чем различия между химическими и электрохимическими методами нанесения металлических покрытий?
2. Как можно управлять толщиной металлических покрытий и какие существуют ограничения толщины покрытия? Каковы ограничения использования высоких плотностей тока при электрохимическом нанесении покрытий?
3. Каким образом можно управлять структурой электроосажденных покрытий, а, следовательно, их физико-механическими свойствами?
4. Чем определяется достижение определенных скоростей железнения в различных электролитах (почему используется строго определенный интервал плотностей тока при заданной температуре и чем определяется его величина)?
5. Напишите основную, а также побочные электрохимические реакции при железнении. Почему выход металла по току уменьшается с ростом концентрации кислоты?
6. В чем заключаются преимущества использования борфторидных электролитов железнения по сравнению с сульфатными и хлористыми?
7. Объясните необходимость использования перед железнением предварительной анодной обработки деталей.
8. Перечислите все возможные причины необходимости хромирования изделий.
9. Напишите уравнения всех электрохимических процессов, протекающих при электроосаждении хрома из Cr(VI) и объясните: а) какую роль играет сульфат-ион в процессе; б) почему имеет место возрастающая зависимость выхода по току от плотности тока при хромировании; в) возможные причины низкой рассеивающей (кроющей) способности электролита хромирования, содержащего серную кислоту и хромовый ангидрид?
10. Почему при хромировании используются свинцовые аноды? Какие анодные реакции на них протекают?
11. Опишите условия, при которых образуются хромовые покрытия следующего вида: а) блестящие; б) молочные; в) матовые; г) серебристые, мелкозернистые; д) покрытия отсутствуют
12. Для чего используются медные гальванические покрытия?
13. В чем особенности использования медно-сульфатных и цианистых электролитов меднения? Почему последние обладают более высокой рассеивающей способностью?
14. Почему борфтористоводородные электролиты меднения обладают высокой производительностью?
15. Перечислите возможные методы интенсификации процессов меднения.
Вопросы для самопроверки к лекции 13.
1. Назначение процессов оксидирования. Механизм возникновения и роста пленки при анодном оксидировании. Почему в определенных условиях на металле происходит оксидирование, а в других – его растворение?
2. Чем объясняется, что цветом и свойствами анодных покрытий можно управлять, включая в электролит соответствующие добавки?
3. Объясните, почему можно получать электрохимически изоляционные анодные покрытия? Где они используются?
4. При каких условиях возможно электрохимическое полирование? Опишите требования к составу электролита и режимам электролиза для электрохимического полирования?
5. Чем отличаются электролиты и режимы электролиза, используемые при анодном оксидировании и электрохимической размерной обработке металлов?
6. Почему при электрохимической размерной обработке металлов необходимо использование высоких плотностей тока и малых межэлектродных зазоров?
7. Почему при электрохимической размерной обработке металлов возможно использование таких высоких плотностей тока, которые не могут быть использованы в процессах электроосаждения?
8. И при электрохимическом полировании и при электрохимической размерной обработке металлов используется анодное растворение металла. В чем общность и в чем различие этих технологических процессов с точки зрения: а) используемых электролитов и режимов электролиза; б) технологических и конструктивных особенностей оборудования?
Вопросы для самопроверки к лекциям 14 и 15.
1. Для каких целей может быть использован электролиз расплавов, в чем его преимущества перед электролизом растворов? И в чем недостатки?
2. В чем преимущества металлов, получаемых электролизом расплавов (по сравнению с электролизом растворов) и за счет чего они достигаются?
3. Почему при электролизе расплавов, как правило, не требуется внешних источников нагрева и по каким причинам этого невозможно достичь при использовании электролиза водных растворов?
4. Почему при электролизе расплавов практически отсутствуют концентрационная поляризация?
5. Что такое анодный эффект и каковы причины его возникновения? Как используется анодный эффект в электролизе расплавов?
6. Опишите возможные методы получения и очистки глинозема при переработке бокситов.
7. Каковы причины снижения выхода по току по сравнению со 100% при получении алюминия?
8. Каковы причины загрязнения алюминия-сырца и как осуществляется процесс рафинирования алюминия. Что является анодом в процессе рафинирования?
9. Перечислите возможные методы снижения энергоемкости при получении алюминия и его рафинировании.
10. В чем преимущества получения алюминия электролизом хлорида алюминия?
Вопросы для самопроверки к лекциям 16 и 17.
1. Что такое гидроэлектрометаллургия, в чем ее отличия от металлургии?
2. Каковы физические основы рафинирования металлов в гидроэлектрометаллургии?
3. В чем особенности электроэкстракции?
4. Почему в гидроэлектрометаллургии получили применение в основном сульфатные электролиты?
5. Каковы требования к катодам-матрицам и катодам-основам в гидроэлетрометаллургии?
6. Перечислите все возможные технологические процессы гидроэлектрометаллургии. В чем их особенности?
7. Физические основы технологии рафинирования серебра. Чем определяется выбор плотности тока?
8. Физические основы технологии рафинирования золота. Почему при рафинировании золота используется нестационарный электролиз?
Заключение
Дата добавления: 2017-01-29; просмотров: 4234;
