Лекция 16. Гидроэлектрометаллургия
Области применения гидроэлектрометаллургии. Гидроэлектрометалургия - это способ (вернее группа способов) электролитического выделения или рафинирования (т.е. очистки) металлов из водных растворов, которые являются продуктом выщелачивания (химического растворения) полиметаллических руд или получаются в результате электрохимического (анодного) растворения продуктов пирометаллургического (огневого) их восстановления. Промышленное развитие гидроэлектрометаллургия получила в конце позапрошлого столетия после появления мощных источников питания. В течение сорока лет, начиная с 80-х годов XX века были организованы производства с крупными электролизными цехами для получения чистых меди, кадмия, свинца, олова, никеля, кобальта, марганца и хрома.
Основным процессом в гидроэлектрометаллургии является электролиз, но не все металлы можно получить электролизом водных растворов.
Некоторые металлы извлекают из руд в основном способами пирометаллургии, и только конечная стадия – получение чистого металла осуществляется электролитическим рафинированием или электроэкстракцией.
Электролитическое рафинирование предусматривает анодное растворение пирометаллургического загрязненного металла и катодное его осаждение в более чистом виде в том же электролизере (рис. 16.1). При этом в качестве товарных продуктов получают металлы как в результате пирометаллургической переработки (металлы пониженной чистоты), так и электролитического рафинирования (чистые металлы).
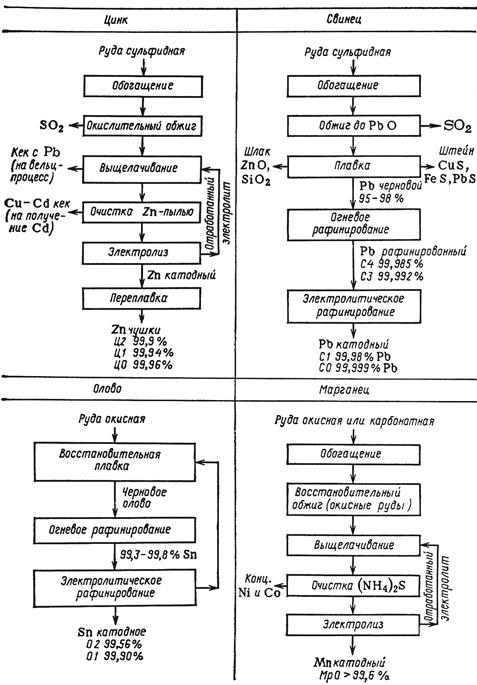
Рис. 16.1а. Принципиальные схемы переработки руд.
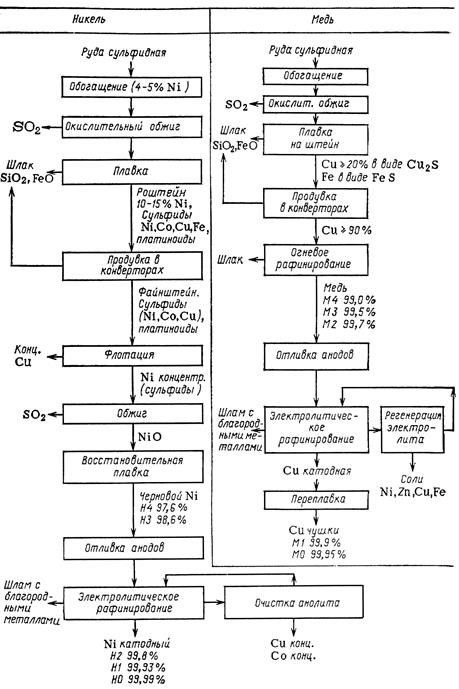
Рис. 16.1б. Принципиальные схемы переработки руд.
Другие металлы после извлечения их соединений из руд различными растворителями (в том числе и отработанным электролитом) и отделения от других компонентов руды, выделяют в чистом виде на катоде в электролизере с нерастворимыми анодами. Этот способ для краткости иногда называют электроэкстракцией.
Рафинирование и электроэкстракцию из водных растворов осуществляют с применением как твердых, так и жидких электродов – ртути и ее сплавов (амальгамная металлургия). Закономерности обоих процессов близки между собой, однако практическое распространение получил первый способ.
Вместо восстановления ионов металлов из водных растворов на катоде с применением источников постоянного тока, возможно, их восстановление при определенных условиях другим металлом, с более электроотрицательным потенциалом, или водородом. Такие процессы носят название цементации и вытеснения и также могут быть отнесены к электрохимическим процессам.
Гидроэлектрометаллургические процессы включают две основные стадии: подготовку электролита и извлечение из него металла (рис. 16.1). Для организации процесса получения металла с высокими показателями важны обе стадии.
Одним из преимуществ гидрометаллургических методов является то, что они часто позволяют более полно по сравнению с металлургическими процессами перерабатывать бедные и полиметаллические руды с раздельным получением всех полезных компонентов, а основного – в виде продукта высокой чистоты.
Подготовка электролита. В процессах гидроэлектрометаллургического передела руд подготовка электролита может включать обжиг руды или концентрата, выщелачивание продукта обжига или самой руды соответствующим жидким реагентом (часто – отработанным кислым электролитом) и очистку раствора от нежелательных компонентов. В результате каждой из этих операций выделяют побочные продукты, обычно тоже используемые (на рис. 16.1 они выделены).
Обжиг руды и концентратов. Путем обжига руд основной компонент переводят в форму, более удобную для выщелачивания. Это улучшает его растворимость, предотвращает вредные выделения и облегчает отделение основного компонента от других.
Обжиг является сложным химико-металлургическим процессом. В зависимости от условий проведения различают основные группы обжигов: окислительный обжиг, при котором находящиеся в руде сульфиды переходят в сульфаты или оксиды
2MS + 2O2 → 2MO + SO2;
сульфитирующий обжиг при более низких температурах; восстановительный обжиг, позволяющий переводить высшие оксиды в низшие
MnO2 + C → MnO + CO
и хлорирующий обжиг, с помощью которого оксиды металлов превращаются в соответствующие хлориды
MO + Cl2 → MCl2 + ½O2
MS + 2O2 + 2NaCl → MCl2 + Na2SO4 (16.а)
MSO4 + 2NaCl → MCl2 + Na2SO4 и
кальцинирующий обжиг, применяемый с целью удаления двуокиси углерода и предотвращения излишнего вспенивания при выщелачивании
MCO3 → MO + CO2.
Обжиг ведут в печах разнообразных конструкций: горизонтальных, трубчатых, шахтных, а также в многоподовых печах с гребками, расположенными на центральном вращающемся валу, для передачи руды с одного пода на другой. В последние годы в гидрометаллургии получили распространение печи кипящего слоя (КС), вихревые печи.
Процессы выщелачивания. Выбор аппарата для выщелачивания зависит в основном от типа руды и требований, которые предъявляются к скорости и стоимости процесса выщелачивания.
Первыми аппаратами, применявшимися для выщелачивания при атмосферном давлении, были т.н. перколяторы. Однако в них не обеспечивается интенсивное выщелачивание, так как раствор в крупных чанах просто просачивается сквозь слой кусковой руды. В то же время этот процесс дешев, его проведение не связано с затратами энергии. В последние годы перколяторы вновь стали применяться в гидроэлектрометаллургии меди.
Более распространены чаны с механическим перемешиванием пропеллерными, цепными или гребковыми мешалками. В тех случаях, когда при выщелачивании руды не окисляются с понижением растворимости, применяют чаны с воздушным перемешиванием: аэролифтные аппараты «Пачуки» (от названия местности в Мексике), в которых перемешивание осуществляется сжатым воздухом. Давление подаваемого воздуха обычно равно 0,2 – 0,3 МПа.
Автоклавный метод обработки руд характеризуется возможностью проведения процессов при повышенных давлениях и температурах. При этом в одном процессе сочетаются обжиг и выщелачивание руды. Замена пирометаллургического процесса автоклавным гидрометаллургическим – одно из наиболее перспективных направлений при использовании бедных руд. При высоких давлениях (0,5 – 2 МПа) и температурах от 100 до 200 °С химические реакции сильно ускоряются. При автоклавной обработке становятся возможными процессы, не протекающие в обычных условиях. В автоклавах могут быть проведены реакции простого обмена (типа MO + H2SO4 → MSO4 + H2O), реакции обменного разложения солей, а также реакции окисления и восстановления. Например, возможно одновременное окисление и выщелачивание сульфидов:
2MS + O2 + 2H2SO4 → 2MSO4 + 2S + 2H2O (16.б)
Автоклавный метод, давно используемый для переработки бокситов в производстве алюминия, применительно к гидрометаллургическим процессам интенсивно разрабатывается только в последнее время.
Очистка растворов. Как в пирометаллургически рафинируемом металле, так и в растворах рудного выщелачивания содержатся компоненты, отрицательно влияющие на электролиз. В ряде случаев в отделении подготовки электролита должна быть предусмотрена возможность очистки раствора от этих примесей.
В гидроэлектрометаллургии нашли применение различные методы разделения компонентов раствора, например, осаждение малорастворимых соединений, вытеснение, экстракция, адсорбция, ионный обмен и электрохимический метод.
Электрохимические способы извлечения металлов из растворов. К электрохимическим способам извлечения металлов из растворов могут быть отнесены способы вытеснения и электролиза с твердым и ртутным катодами.
Способы вытеснения. Один из них – цементация – получил распространение не только для очистки растворов от нежелательных компонентов, но и для извлечения металлов из разбавленных растворов (например, золота, иногда меди и др.).
Другая разновидность способа вытеснения – получение порошков металлов путем вытеснения металла водородом в автоклавах. Процесс протекает при адсорбции газообразного водорода на зернах металла, служащих катализатором, поэтому процесс вытеснения носит ярко выраженный гетерогенный характер. Для начала вытеснения в раствор необходимо вводить затравку – зерна порошка никеля или железа, служащие катализатором. Дальнейшее восстановление может протекать уже с участием порошка, образующегося при вытеснении.
Процессы рафинирования и экстракции металлов с твердыми и жидкими электродами. Механизм процессов электрохимического рафинирования с твердыми электродами основан на том, что системы Mz+/M в зависимости от металла и состава раствора, а также от плотности тока и других факторов, характеризуются различными электродными потенциалами и разными скоростями процессов растворения и разряда.
Продуктами рафинирования являются катодный металл, компоненты раствора электролита и анодный шлам (газы не учитываются). Составляющие анодного металла распределяются между этими тремя продуктами в соответствии с их реальными потенциалами и скоростями растворения и осаждения.
Из анода, состоящего из основного металла и некоторых примесей, в первую очередь растворяются металлы с наиболее отрицательными потенциалами. При этом общий потенциал анода является компромиссным (смешанным), но практически обусловлен потенциалом растворения основного металла, так как растворение примесей протекает при предельном токе из-за малой концентрации их.
Если расположить металлы по значениям потенциалов от более электроположительных к более электроотрицательным: Au, Ag, Cu, Bi, Sb, Pb, Sn, Ni, Co, Cd, Fe, Cr, Zn, Mn – то в первом приближении можно принять, что при рафинировании каждого из них все расположенные левее металлы перейдут в шлам, а расположенные правее перейдут в раствор вместе с основным металлом. На катоде совместно с основным металлом будет происходить разряд ионов расположенных левее перешедших в раствор металлов, а ионы, расположенные правее, - будут накапливаться в растворе. Таким образом, рафинированию анодного металла способствует как анодный процесс (более электроположительные металлы выделяются в шлам), так и катодный процесс, в результате которого электроотрицательные примеси собираются в растворе. В шлам, кроме более электроположительных, чем основной, металлов, попадают также крупные частицы основного металла, потерявшие связь с анодом при растворении более мелких частиц, а также оксиды, сульфиды, селениды, углерод, силикаты, нерастворимые при данном потенциале анода. Часто в анодном шламе обнаруживаются и слаборастворимые соединения (гидроксиды, соли). В ряде случаев анодный шлам представляет собой ценный промежуточный продукт, подлежащий переработке.
Наличие в растворе ионов с более электроположительным потенциалом, чем основного иона, нежелательно. При малых концентрациях эти ионы разряжаются на катоде при предельном токе, т.е. скорость лимитируется диффузией ионов примеси к катоду.
Для разряда примеси на предельном токе было показано, что содержание примеси в катодном металле АМ (в %) зависит от плотности тока и концентрации примеси в растворе:
АМ = 1000 КМСМ / i (16.1)
где i – плотность тока, кА/м2; СМ – концентрация примеси в растворе, экв/л; КМ – константа скорости диффузии ионов примеси при данных условиях конвекции.
При электроэкстракции с твердыми электродами катодный процесс, в общем, сходен с процессом рафинирования, а анодные процессы коренным образом отличаются, так как аноды изготовляют из чужеродных материалов.
Анод практически нерастворим (его ионы не переходят или переходят в малом количестве в раствор), и пропущенное количество электричества затрачивается на один из процессов окисления:
4OH- → O2+ 2H2O + 4 
2H2O → O2 + 4H+ + 4  (16.в)
(16.в)
2Cl- → Cl2 + 2 
Если сравнить потенциалы этих процессов с учетом их перенапряжений с соответствующими потенциалами важнейших металлов, то станет очевидным, что растворение даже таких металлов как медь и серебро, протекает при менее положительных значениях потенциалов. Причина нерастворимости металла при анодной поляризации в то время, когда его потенциал должен иметь достаточно отрицательное значение, заключается в пассивности электрода.
Потенциал, при котором наступает пассивность (так называемый потенциал пассивации), и глубина пассивации, т.е. степень уменьшения скорости растворения, зависят от свойств металла и электролита. Так, никель, железо и стали пассивируются быстро и глубоко в растворах щелочей и поэтому практически не растворяются в этих средах. Свинец быстро и глубоко пассивируется в сернокислых (нейтральных и кислых) растворах.
Механизм процессов электрохимического рафинирования и электроэкстракции с применением жидких электродов из ртути или ее сплавов – амальгамная металлургия – сходен с механизмом процессов, протекающих на твердых электродах.
Особенностями электролиза с ртутными электродами, отличающими его от процессов на твердых электродах, являются высокое перенапряжение выделения водорода
 (16.2)
(16.2)
и значительная деполяризация вследствие образования сплава металла с ртутью. Оба эти обстоятельства позволяют выделять из водных растворов даже такой металл, как натрий.
Электролиз с твердыми электродами. В гидроэлектрометаллургии практическое применение получили в основном, сульфатные электролиты. Растворы хлоридов обладают более высокой электропроводностью и позволяют работать при значительно более высоких плотностях тока. Однако выделение на аноде токсичного хлора связано с необходимостью герметизации ванны, что осложняет процесс. В процессах рафинирования хлориды часто вводят в качестве добавки для активирования анодов, а также для повышения проводимости электролита. Нитратные растворы практически используют только для рафинирования, так как подбор анодов, стойких в этой среде, затруднителен. В некоторых случаях применяются и более сложные электролиты.
Целесообразность любой попытки интенсифицировать процесс электролиза путем повышения плотности тока должна быть оценена с точки зрения влияния на т.н. экономическую плотность тока, которая учитывает не только увеличение производительности процесса, но и экономические показатели, обусловленные увеличением энергозатрат
При выборе температуры электролита следует учитывать ее влияние на электропроводимость раствора и перенапряжение выделения металла и водорода. В некоторых случаях при увеличении температуры нужно принимать во внимание повышение коррозионной активности электролита, возможность его разложения и укрупнение зерен осадка на катоде.
Оборудование электролизных цехов. Осаждение металла в большом числе однотипных ванн и продолжительное наращивание слоя металла на одном и том же электроде позволяют без ущерба для процесса включать эти ванны последовательно, сериями. Число ванн в серии при данном напряжении источника тока зависит от напряжения на одном электролизере, складывающемся из разности рабочих потенциалов анода и катода, падения напряжения в электролите, диафрагмах, шламе и проводниках первого рода.
Соединение электродов в электролизерах. Применяемые в настоящее время способы включения электродов были разработаны при изучении первого промышленного процесса электролиза с получением металла – рафинирования меди. Как при параллельном, так и при последовательном электрических включениях электродов, электроды могут располагаться либо поперек ванн, либо, что реже, вдоль боковых стенок.
Последовательное включение биполярных электродов применяют главным образом при оформлении процессов рафинирования, когда с одной стороны электрод растворяется, с другой – наращивается чистым металлом.
Для биполярных электродов требуется большая тщательность при отливке и обслуживании. Они применяются реже монополярных.
Электроды обычно опираются на борта электролизеров, из которых расположены токоподводящие шины и изоляторы.
Важнейшим фактором для обеспечения нормальной работы электролизеров и экономии энергии является наличие хорошего электрического контакта между валом электрода и токоподводящей шиной на ванне.
Электроды. Катоды, применяемые в гидроэлектрометаллургии, могут быть подразделены на катоды-матрицы, с которых снимают наращиваемый слой металла определенной толщины, и катоды-основы, которые вместе с наращиваемым металлом поступают на переплавку или прямо к потребителю.
Катоды-матрицы должны служить длительное время. Этим и объясняются предъявляемые к ним высокие требования. Наращиваемый металл должен легко сниматься с катодов без коробления матриц, поэтому в качестве матричного металла используют алюминий, титан или нержавеющую сталь, т.е. металлы, окисляющиеся на воздухе, и не обладающие высоким сцеплением с осаждаемым металлом. Катоды-матрицы должны обладать высокой химической стойкостью в электролите, чтобы основной металл не загрязнялся продуктами их коррозии.
Диафрагмы. В гидроэлектрометаллургии обычно применяют фильтрующие диафрагмы. В электролизерах с фильтрующей диафрагмой обеспечивается циркуляция раствора из одного электродного пространства в другое противотоком ионам, стремящимся проникнуть в ограждаемое от них электродное пространство.
Питание ванн электролитом. При длительном ведении электролиза состав электролита должен поддерживаться постоянным по концентрациям основного иона и добавок, а также рН.
При рафинировании постоянство концентрации основного иона достигается поддержанием близких выходов по току на катоде и аноде, в процессах электроэкстракции с нерастворимыми анодами – питанием катодного пространства свежим раствором, обогащенным основным ионом в процессе выщелачивания руд или огарков. Таким образом, во втором случае циркуляция электролита – ввод более концентрированного и выход обедненного раствора – особенно необходима, хотя она осуществляется и при рафинировании для корректирования и выравнивания параметров электролиза.
Правильная организация движения электролита должна быть в каждом случае тщательно продумана. В общую схему циркуляции включают помимо самих электролизеров напорные и сливные баки, часто при циркуляции происходит нагревание или охлаждение раствора.
В практике получили применение две схемы питания: так называемая каскадная, когда электролит перетекает из одной ванны в другую самотеком благодаря ступенчатому расположению ванн, и схема независимого питания электролизеров от генеральных трубопроводов с ответвляющимися патрубками.
С точки зрения интенсификации процесса электролиза, наиболее удачной схемой, оправдавшей себя при осуществлении процессов рафинирования, является так называемая прямоточная система циркуляции электролита. Движение электролита вдоль поверхности электродов обеспечивает значительный обмен электролита и позволяет применять более высокие плотности тока. Перегородки между ваннами изготовляют из кислотоупорного кирпича.
Принципы создания современных ванн для электролиза водных растворов с получением металлов на твердых катодах одинаковы, независимо от получаемого металла. Такие электролизеры состоят из определенных конструкционных элементов. Корпуса ванн могут быть изготовлены из дерева, железобетона, стали, пластмасс.
Дата добавления: 2017-01-29; просмотров: 1729;
