Характеристика газообразного состояния вещества
Агрегатные состояния веществ, их характеристика
В зависимости от внешних условий (температуры и давления) каждое вещество может находиться в одном из трех агрегатных состояний: твердом, жидкомили газообразном.Эти состояния называются агрегатными состояниями.Для некоторых веществ характерно только два или даже одно агрегатное состояние. Например, нафталин, йод при нагревании в обычных условиях из твердого состояния переходят в газообразное, минуя жидкое. Такие вещества, как белки, крахмал, каучуки, имеющие огромные макромолекулы, не могут существовать в газообразном состоянии.
Газы не имеют постоянной формы и постоянного объема. Жидкости имеют постоянный объем, но не имеют постоянной формы. Твердые характеризуются постоянством формы и объема.
Характеристика газообразного состояния вещества
Для газов характеры следующие свойства:
- равномерное заполнение всего предоставленного объема;
- малая плотность по сравнению с жидкими и твердыми веществами и большая скорость диффузии;
- сравнительно легкая сжимаемость.
Эти свойства определяются силами межмолекулярного притяжения и расстоянием между молекулами.
В газе молекулы находятся на очень большом расстоянии друг от друга, силы притяжения между ними ничтожно малы. При низких давлениях расстояния между молекулами газа настолько велики, что по сравнению с ними размером молекул, а, следовательно, объемом молекул в общем объеме газа можно пренебречь. При больших расстояниях между молекулами практически отсутствуют силы притяжения между ними. Газ в таком состоянии называется идеальным.При нормальных условиях Т=273 0К (0 0С) и p=101,325 кПа реальные газы независимо от природы можно считать идеальными иприменять к ним уравнение состояния идеального газа (уравнение Клайперона-Менделеева):
PV = n RT, (2.1)
где Р– давление газа,
V – объем газа,
n – количество вещества,
R – универсальная газовая постоянная (в единицах СИ R =8,314 Дж/мольК),
Т – абсолютная температура.
Реальные газы при высоких давлениях и низких температурах не подчиняются уравнению состояния идеального газа, так как в этих условиях начинают проявляться силы взаимодействия между молекулами и уже нельзя пренебрегать собственным объемом молекул по сравнению с объемом тела. Для математического описания поведения реальных газов используют уравнение Ван-дер-Ваальса:
(р + n2 a/V2) (V – nb) = vRT, (2.2)
где а и b – постоянные,
a/V2 – поправка на взаимное притяжение,
b – поправка на собственный объем молекул,
n– число молей газа.
С увеличением давления и понижением температуры расстояния между молекулами уменьшаются, а силы взаимодействия увеличиваются так, что вещество из газообразного состояния может перейти в жидкое. Для каждого газа существует предельная критическая температура,выше которой газ не может быть превращен в жидкость ни при каком давлении. Давление, необходимое для сжижения газа при критической температуре, называется критическим давлением,а объем одного моля газа при этих условиях критическим объемом.
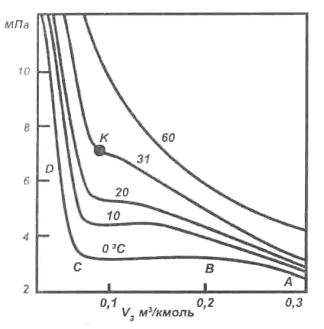
Рис. 1. Изотермы реального газа
Состояние газа при критических параметрах называют критическим состоянием.В критическом состоянии исчезает различие между жидкостью и газом, они имеют одинаковые физические свойства.
Переход газа в жидкость можно показать графически. На рисунке 1 приведена графическая зависимость между объемом и давлением при постоянных температурах. Такие кривые называются изотермами.У изотерм можно выделить три участка: АВ, ВС, CD при низких температурах. АВ – соответствует газообразному состоянию, ВС – отвечает переходу газа в жидкость, CD – характеризует жидкое состояние. С повышением температуры участок ВС уменьшается и превращается в точку перегиба К, называемую критической точкой.
Сжиженные газы находят большое промышленное применение. Жидкий СО 2 используется для газирования фруктовых и минеральных вод, приготовления шипучих вин. Жидкий SO2 используют как дезинфицирующее средство для уничтожения плесневых грибков в подвалах, погребах, винных бочках, бродильных чанах. Жидкий азот широко применяют в медицине и биологии для получения низких температур при консервировании, замораживании крови и биологических тканей. Жидкие газы удобнее транспортировать.
Дата добавления: 2017-01-29; просмотров: 21373;
