ЖИРОРАСТВОРИМЫЕ ВИТАМИНЫ
1. Витамин А (ретинол) - циклический, ненасыщенный, одноатомный спирт.
Источники. Витамин А содержится только в животных продуктах: печени крупного рогатого скота и свиней, яичном желтке, молочных
Строение провитамина А (1), витамина А (2) и его производных (3, 4)
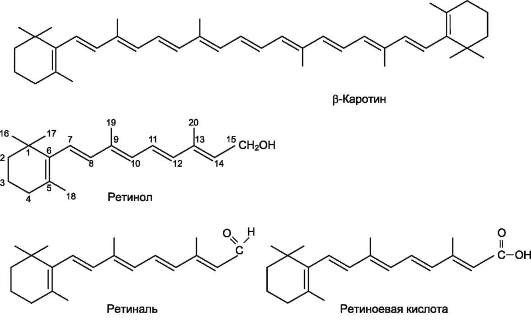
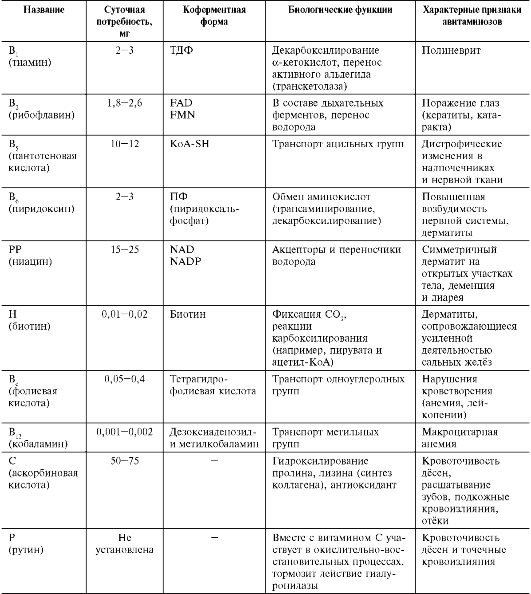
Таблица 3-2. Водорастворимые витамины
продуктах; особенно богат этим витамином рыбий жир. В растительных продуктах (морковь, томаты, перец, салат и др.) содержатся каротиноиды, являющиеся провитаминами А. В слизистой оболочке кишечника и клетках печени содержится специфический фермент каротиндиоксигеназа, превращающий кароти-ноиды в активную форму витамина А. Суточная потребность витамина А взрослого человека составляет от 1 до 2,5 мг витамина или от 2 до 5 мг β-каротинов. Обычно активность витамина А в пищевых продуктах выражается в международных единицах; одна международная единица (МЕ) витамина А эквивалентна 0,6 мкг β-каротина и 0,3 мкг витамина А.
Биологические функции витамина А. В организме ретинол превращается в ретиналь и ретиное-вую кислоту, участвующие в регуляции ряда функций (рост и дифференцировка клеток); они также составляют фотохимическую основу акта зрения.
Наиболее детально изучено участие витамина А в зрительном акте (рис. 3-3). Светочувствительный аппарат глаза - сетчатка. Падающий на сетчатку свет адсорбируется и трансформируется пигментами сетчатки в другую форму энергии. У человека сетчатка содержит 2 типа рецепторных клеток: палочки и колбочки. Первые реагируют на слабое (сумеречное) освещение, а колбочки - на хорошее освещение (дневное зрение).
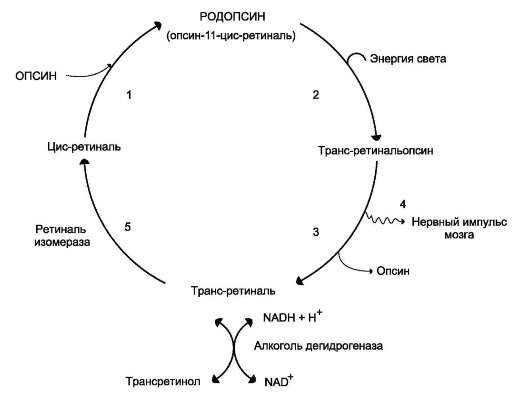
Рис. 3-3. Схема зрительного цикла.1 - цис-ретиналь в темноте соединяется с белком опсином, образуя родопсин; 2 - под действием кванта света происходит фотоизомеризация 11-цис-ретиналя в транс-ретиналь; 3 - транс-ретиналь-опсин распадается на транс-ретиналь и опсин; 4 - поскольку пигменты встроены в мембраны светочувствительных клеток сетчатки, это приводит к местной деполяризации мембраны и возникновению нервного импульса, распространяющегося по нервному волокну; 5 - заключительный этап этого процесса - регенерация исходного пигмента. Это происходит при участии ретинальизомеразы через стадии: транс-ретиналь - трансретинол - цис-ретинол - цис-ретиналь; последний вновь соединяется с опсином, образуя родопсин.
Палочки содержат зрительный пигмент родопсин, а колбочки - йодопсин. Оба пигмента - сложные белки, отличающиеся своей белковой частью. В качестве кофер-мента оба белка содержат 11-цис-ретиналь, альдегидное производное витамина А.
Ретиноевая кислота, подобно стероидным гормонам, взаимодействует с рецепторами в ядре клеток-мишеней. Образовавшийся комплекс связывается с определёнными участками ДНК и стимулирует транскрипцию генов (см. раздел 4). Белки, образующиеся в результате стимуляции генов под влиянием ретиноевой кислоты, влияют на рост, дифференцировку, репродукцию и эмбриональное развитие (рис. 3-4).
Основные клинические проявления гиповитаминоза А. Наиболее ранний и характерный признак недостаточности витамина А у людей и экспериментальных животных - нарушение сумеречного зрения (гемералопия, или «куриная» слепота). Специфично для авитаминоза А поражение глазного яблока - ксерофталь-мия, т.е. развитие сухости роговой оболочки глаза как следствие закупорки слёзного канала в связи с ороговением эпителия. Это, в свою очередь, приводит к развитию конъюнктивита, отёку, изъязвлению и размягчению роговой оболочки, т.е. к кератома-ляции. Ксерофтальмия и кератомаляция при отсутствии соответствующего лечения могут привести к полной потере зрения.
У детей и молодых животных при авитаминозе А наблюдают остановку роста костей, кератоз эпителиальных клеток всех органов и, как следствие этого, избыточное ороговение кожи, поражение эпителия ЖКТ, мочеполовой системы и дыхательного аппарата. Прекращение роста костей черепа приводит к повреждению тканей ЦНС, а также к повышению давления спинномозговой жидкости. 2. Витамины группы D (кальциферолы) Кальциферолы - группа химически родственных соединений, относящихся к производным стеринов. Наиболее биологически активные витамины - D2 и D3. Витамин D2 (эргокальцифе-рол), производное эргостерина - растительного стероида, встречающегося в некоторых грибах, дрожжах и растительных маслах. При облучении пищевых продуктов УФО из эргостерина получается витамин D2, используемый в лечебных целях. Витамин D3, имеющийся у человека и животных, - холекальциферол, образующийся в коже человека из 7-дегидрохолестерина под действием УФ-лучей (рис. 3-5).
Витамины D2 и D3 - белые кристаллы, жирные на ощупь, нерастворимые в воде, но хорошо растворимые в жирах и органических растворителях.
Источники. Наибольшее количество витамина D3 содержится в продуктах животного происхождения: сливочном масле, желтке яиц, рыбьем жире.
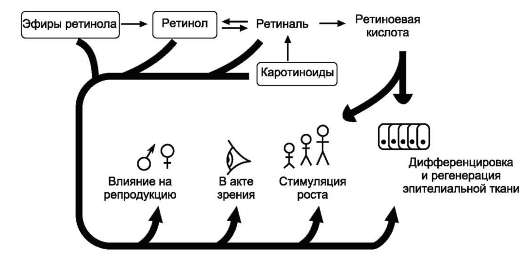
Рис. 3-4. Действие ретиноидов в организме.Вещества (названия в рамках) - компоненты пищи.
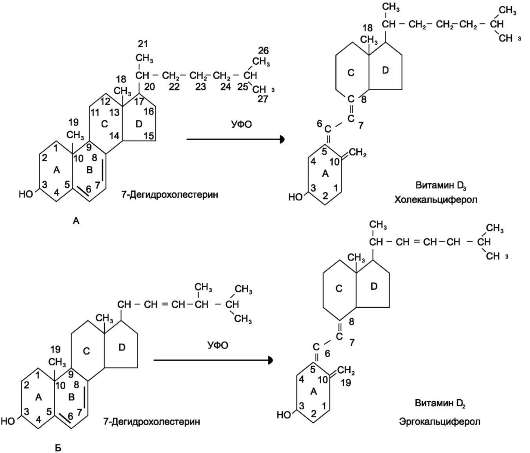
Рис. 3-5. Схема синтеза витаминов D2 и D3.Провитамины D2 и D3 - стерины, у которых в кольце В две двойные связи. При воздействии света в процессе фотохимической реакции происходит расщепление кольца В. А - 7-дегидрохолестерин, провитамин D3 (синтезируется из холестерина); Б - эргостерин - провитамин D2.
Суточная потребность для детей 12-25 мкг (500-1000 МЕ), для взрослого человека потребность значительно меньше.
Биологическая роль. В организме человека витамин D3 гидроксилируется в положениях 25 и 1 и превращается в биологически активное соединение 1,25-дигидроксихолекальцифе-рол (кальцитриол). Кальцитриол выполняет гормональную функцию, участвуя в регуляции обмена Са2+ и фосфатов, стимулируя всасывание Са2+ в кишечнике и кальцифи-
кацию костной ткани, реабсорбцию Са2+и фосфатов в почках. При низкой концентрации Са2+ или высокой концентрации D3он стимулирует мобилизацию Са2+ из костей (см. раздел 11). Недостаточность. При недостатке витамина D у детей развивается заболевание «рахит», характеризуемое нарушением кальцифика-ции растущих костей. При этом наблюдают деформацию скелета c характерными изменениями костей (Х- или о-образная форма
ног, «чётки» на рёбрах, деформация костей черепа, задержка прорезывания зубов). Избыток. Поступление в организм избыточного количества витамина D3 может вызвать гипервитаминоз D. Это состояние характеризуется избыточным отложением солей кальция в тканях лёгких, почек, сердца, стенках сосудов, а также остеопорозом с частыми переломами костей. 3. Витамины группы Е (токоферолы) Витамин Е был выделен из масла зародышей пшеничных зёрен в 1936 г. и получил название токоферол. В настоящее время известно семейство токоферолов и токотриенолов, найденных в природных источниках. Все они - метильные производные исходного соединения токола, по строению очень близки и обозначаются буквами греческого алфавита. Наибольшую биологическую активность проявляет α-токоферол.
Токоферолы представляют собой маслянистую жидкость, хорошо растворимую в органических растворителях.
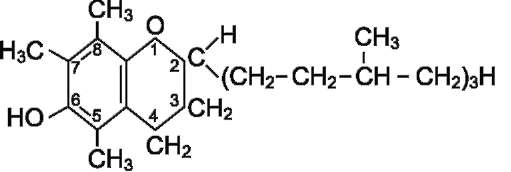
α-Токоферол (5,7,8-триметилтокол)
Источники витамина Е для человека - растительные масла, салат, капуста, семена злаков, сливочное масло, яичный желток.
Суточная потребность взрослого человека в витамине примерно 5 мг.
Биологическая роль. По механизму действия токоферол является биологическим анти-оксидантом. Он ингибирует свободноради-кальные реакции в клетках и таким образом препятствует развитию цепных реакций перекисного окисления ненасыщенных жирных кислот в липидах биологических мембран и других молекул, например ДНК (см. раздел 8). Токоферол повышает биологическую активность витамина А, защищая от окисления ненасыщенную боковую цепь.
Клинические проявления недостаточности витамина
Е у человека до конца не изучены. Известно положительное влияние витамина Е при ле-
чении нарушения процесса оплодотворения, при повторяющихся непроизвольных абортах, некоторых форм мышечной слабости и дистрофии. Показано применение витамина Е для недоношенных детей и детей, находящихся на искусственном вскармливании, так как в коровьем молоке в 10 раз меньше витамина Е, чем в женском. Дефицит витамина Е проявляется развитием гемолитической анемии, возможно из-за разрушения мембран эритроцитов в результате ПОЛ. 4. Витамины K (нафтохиноны) Витамин К существует в нескольких формах в растениях как филлохинон (К1), в клетках кишечной флоры как менахинон (К2).
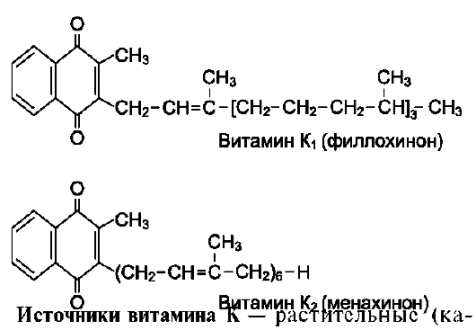
пуста, шпинат, корнеплоды и фрукты) и животные (печень) продукты. Кроме того, он синтезируется микрофлорой кишечника. Обычно авитаминоз К развивается вследствие нарушения всасывания витамина К в кишечнике, а не в результате его отсутствия в пище.
Суточная потребность в витамине взрослого человека составляет 1-2 мг.
Биологическая функция витамина К связана с его участием в процессе свёртывания крови (рис. 3-6). Он участвует в активации факторов свёртывания крови: протромбина (фактор II), проконвертина (фактор VII), фактора Кристмаса (фактор IX) и фактора Стюарта (фактор X). Эти белковые факторы синтезируются как неактивные предшественники. Один из этапов активации - их карбоксилирование по остаткам глутами-новой кислоты с образованием γ-карбок-сиглутаминовой кислоты, необходимой для связывания ионов кальция (см. раздел 13).
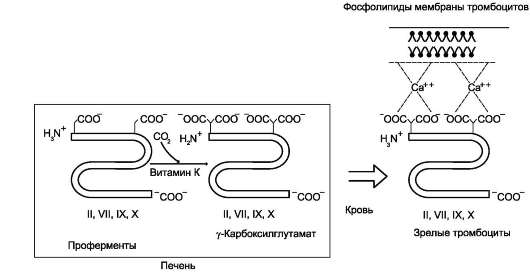
Рис. 3-6. Роль витамина К в свёртывании крови.
Витамин К участвует в реакциях карбокси-лирования в качестве кофермента. Для лечения и предупреждения гиповитаминоза К используют синтетические производные нафтохинона: менадион, викасол, синкавит.
Основное проявление авитаминоза К - сильное кровотечение, часто приводящее к шоку и гибели организма. В таблице 3-3 перечислены суточные потребности и биологические функции жирорастворимых витаминов, а также характерные признаки авитаминозов.
Таблица 3-3. Жирорастворимые витамины
Механизм действия ферментов сложен и до сих пор полностью не понят. Важнейшие особенности процесса, катализируемого ферментом, можно представить в виде следующих последовательных этапов:
1. Фермент (enzyme, E) соединяется с субстратом (S), т. е. с веществом, на которое он действует: E + S=E—S. Как показывают стрелки, эта реакция обратима.
2. В результате этого соединения возникает E-S, фермент-субстратный комплекс.
3. После соединения с ферментом субстрат активируется, в результате чего входящие в молекулу субстрата атомы и электроны легко перестраиваются, что приводит к образованию продукта этой реакции (Р): E-S=>E-P.
4. Этот комплекс затем подвергается диссоциации, освобождая продукт реакции и свободный фермент: Е-Р=>Е + Р.
Следует отметить, что в ходе реакции химические превращения претерпевает только субстрат; фермент, который действовал лишь в качестве катализатора, остается неизменным. Такой неизменный фермент может реагировать вновь и вновь с другими молекулами субстрата. Поскольку эти реакции протекают очень быстро, небольшое количество фермента катализирует превращение значительных количеств субстрата в продукт реакции за короткое время. В принципе все ферментативные реакции в какой-то мере обратимы, т. е. фермент способен реагировать с продуктом катализируемой им реакции, образуя субстрат. Скорость этой обратной реакции в организме зависит от концентраций участвующих в ней веществ. Накопление продукта может настолько замедлить прямую реакцию, что начнет преобладать обратная. Однако, если продукт реакции обладает значительно меньшим запасом энергии, чем субстрат, обратная реакция становится совершенно невозможной, поскольку она соответствовала бы движению системы вверх по термодинамической лестнице (против градиента энергии). Такие реакции называют необратимыми. В этих случаях обратное превращение продукта реакции в субстрат требует участия другого фермента, который катализировал бы эту обратную реакцию. Если субстраты и продукты реакции могут значительно различаться по химическому строению и размерам, то ферменты непременно представляют собой белки с молекулярным весом от нескольких тысяч до нескольких миллионов. Очевидно, небольшие молекулы таких субстратов, как сахар, могут соединяться с огромной белковой молекулой во многих точках вдоль полипептидной цепи. Фактически в образовании комплекса с субстратом участвует лишь определенная область поверхности молекулы фермента — активный центр. Последний состоит либо из нескольких аминокислот, расположенных последовательно в полипептидной цепи, либо образуется в результате взаимодействия аминокислот, удаленных друг от друга в полипептидной цепи. В последнем случае молекула фермента в активной конфигурации сложена таким образом, чтобы сблизить между собой аминокислоты, принимающие непосредственное участие в построении активного центра. Помимо аминокислотных остатков, активный центр фермента содержит обычно небелковую простетическую группу. Последняя представляет собой либо молекулу органического соединения, либо неорганический атом (обычно атом металла). Простетическая группа играет важную роль в действии фермента, облегчая его связывание с субстратом или осуществляя перенос электронов, атомов или ионов между субстратом и продуктом реакции. В организме простетическая группа прочно связана с ферментом. Когда фермент выделяют из ткани и подвергают очистке, простетическая группа остается с ним связанной. Если простетическую группу отделяют при помощи жестких методов от исходного фермента, или холофермента, то остающийся белок лишается каталитической активности (апофермент). Реконструкция структуры и функции холофермента может быть достигнута путем воссоединения при соответствующих условиях апофермента с его простетической группой, что свидетельствует о важной роли последней.
Факторы, влияющие на активность ферментов: температура, рН среды, действие ингибиторов
Ферменты, обладающие широкой специфичностью, (например, ЩФ) способны катализировать превращение довольно большого числа субстратов. Сродство фермента к субстратам различной природы, а также скорость их превращения могут значительно отличаться. Поэтому значения активности фермента, определённые при испо
льзовании разных субстратов, могут отличаться в несколько раз, и сравнивать их нельзя[10.89].
Степень очистки субстратов, используемых в диагностических наборах, как правило, должна быть не менее 98 %. Примеси, содержащиеся в препаратах субстратов, могут влиять на активность ферментов. Например, примеси в препаратах L- кетоглутарата значительно ингибируют активность АСТ и АЛТ. Кроме того, примеси могут снижать точность измерений. Так, примеси n-нитрофенола в препаратах п-нитрофенилфосфата увеличивают оптическую плотность холостой пробы, что приводит к снижению точности измерений.
Концентрация субстрата — один из наиболее важных факторов, определяющих скорость ферментативной реакции. Концентрация субстрата, при которой достигается максимальная скорость реакции, называется насыщающей концентрацией. При снижении концентрации субстрата в реакционной смеси скорость реакции также снижается. Концентрации субстрата выше насыщающей могут привести к ингибированию фермента и снижению скорости ферментативной реакции.
Таким образом, определение активности ферментов нужно проводить при насыщающей концентрации субстрата.
В качестве буферных соединений в диагностических наборах используют растворы солей неорганических и органических кислот, амины (триоксиметиламинометан, диэтаноламин, триэтиламин, имидазол) и другие соединения. Природа буферного соединения влияет на скорость ферментативной реакции. Например, ион фосфата ингибирует активность ЩФ. Наибольшая скорость гидролиза субстратов ЩФ достигается в диэтаноламиновом буфере, более низкая — в 2-амино-2-метил-1-пропаноловом буфере. Поскольку в наборах для определения ЩФ различные фирмы используют разные буферные растворы, сравнение результатов определения активности, полученных с помощью этих наборов, не всегда возможно.
Буферные соединения, используемые в наборах, должны иметь квалификацию “чда” или “хч”, т.к. примеси ионов металлов могут как ингибировать, так и активировать многие ферменты. Некоторые примеси, например продукты окисления или распада органических соединений, могут инактивировать фермент, ингибировать его активность, или вызвать окрашивание в холостой пробе.
Концентрация буферного соединения влияет на конформацию фермента в растворе и должна быть оптимальной для каждого фермента.
Ферменты чрезвычайно чувствительны к изменениям рН среды. Для каждого фермента существует оптимальное значение рН раствора, при котором превращение субстрата происходит с максимальной скоростью. Например, для ЩФ оптимум рН лежит в области 9,9–10,3, для АСТ и АЛТ — в области 7,2–7,4 и т.д. Небольшие отклонения от оптимального значения рН могут вызвать уменьшение активности фермента в несколько раз.
В качестве активаторов ферментов в диагностических наборах используют ионы металлов (например, ионы магния для ЩФ) или органические соединения (например, пиридоксальфосфат в наборах для определения АСТ и АЛТ). В качестве стабилизаторов используют белки и их гидролизаты, полиэтиленгликоль, сахара, декстран и другие соединения. Как правило, в инструкциях по использованию наборов не указывают состав и количество добавленных стабилизаторов. Поэтому результаты определения активности ферментов наборами различных фирм, и тем более наборами, изготовленными в лаборатории, могут значительно отличаться.
Для большинства очищенных ферментов скорость ферментативной реакции пропорциональна концентрации фермента в реакционной смеси. Это справедливо, например, для реакций, катализируемых ЩФ. Некоторые ферменты (например, АСТ и АЛТ) не подчиняются этой закономерности. При уменьшении их концентрации в реакционной смеси скорость реакции не снижается пропорционально. Это связано со сложными структурными перестройками в молекулах ферментов при разбавлении.
В случае, когда активность ферментов определяют в сыворотке или других биологических жидкостях, где присутствует огромное количество различных соединений, зависимость активности фермента от его концентрации ещё более усложняется. Поэтому очень важно точно соблюдать дозировку сыворотки, указанную в инструкции, и отбор образца сыворотки проводить поверенной автоматической пипеткой.
Установлено, что скорость ферментативных реакций при изменении температуры инкубации на 10 °С изменяется в 2 раза. Например, активность АСТ в сыворотке фирмы Randox, определённая при 37 °С, составляет 35 U/л, а при 25 °C – 16 U/л. При дальнейшем понижении температуры реакционной смеси скорость реакции будет снижаться: при 15 °С активность АСТ равна 8 U/л, при 5 °С — 4 U/л. Поэтому определение активности ферментов необходимо всегда проводить при температуре, указанной в инструкции по использованию набора.
Таким образом, для получения воспроизводимых и сопоставимых данных при определении активности ферментов в биологических жидкостях необходимо учитывать всё многообразие факторов, влияющих на активность ферментов.
6. Понятие о свободных радикалах, источники, биологическая роль оксида азота (NO)
Свободные радикалы. или химические соединения с неспаренным электроном (обозначается жирной точкой), например. Парамагнитны, реакционноспособны. Короткоживущие радикалы - промежуточные частицы во многих химических реакциях. Некоторые радикалы свободные стабильны и выделены в индивидуальном состоянии. С участием радикалов свободных осуществляются важные биохимические процессы, например ферментативное окисление.
Оксид азота (NO) является одним из наиболее важных биологических медиаторов, который вовлечен в множество физиологических и патофизиологических процессов. Он представляет собой уникальный по своей природе и механизмам действия вторичный мессенджер в большинстве клеток организма. В частности, оксид азота участвует в реализации многих важных физиологических функций, таких как вазодилатация, нейротрансмиссия, снижение агрегации тромбоцитов, реакции иммунной системы, регуляция тонуса гладких мышц, состояние памяти и др., а также некоторых патологических процессов. Важная роль оксида азота в многочисленных биологических процессах в организме явилась основанием для того, чтобы назвать NO в 1991 году Молекулой Года.
Термином «оксид азота» (или «окись азота») обозначается восстановленная форма моноокиси азота (NO) с периодом полураспада от 2 до 3 представляет собой растворимый в воде и жирах бесцветный газ с уникальными физиологическими свойствами. В химическом отношении NO представляет собой маленькую липофильную молекулу, состоящую из одного атома азота и одного атома кислорода и имеющую непарный электрон, что превращает ее в высоко реактивный радикал, свободно проникающий через биологические мембраны и легко вступающий в реакции с другими соединениями
Единицы активности ферментов
. Posted in Основы биохимии
Для выражения каталитической активности Комиссией по ферментам Международного биохимического союза (1961 г.) была рекомендована стандартная единица, обозначенная на русском языке - Е, а на английском - U.
С т а н д а р т н а я е д и н и ц а - это такое количество фермента, которое при заданных условиях катализирует превращение одного микромоля субстрата за одну минуту.
В 1972 г. Комиссия по ферментам Международного биохимического союза предложила выражать активность ферментов в к а т а л а х. Катал (символ - кат - это такое количество фермента, которое способно превращать один моль субстрата за одну секунду (при оптимальных условиях).
К производным величинам, характеризующим активность ферментов, относят удельную каталитическую активность ферментов, концентрацию фермента в растворе и другие. Удельную каталитическую активность фермента или ферментативного препарата выражают в каталах на 1 кг белка (кат·кг-1) или чаще в мккат на 1мг белка. Концентрацию фермента в растворе выражают в каталах на 1 литр (кат·л-1) или в других, кратных этому значению величинах.
Специфичность действия ферментов
Различают два главных вида специфичности ферментов: субстратную специфичность и специфичность действия.
Субстратная специфичность, это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
Различают 3 типа субстратной специфичности:
1. абсолютная субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата;
2. относительная субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов;
3. стереоспецифичность - способность фермента катализировать превращения определенных стереоизомеров.
Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции.
В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.
БИЛЕТ11
Кинетика ферментативных реакций изучает закономерности протекания во времени ферментативных р-ций, а также их механизм; разделкинетики химической.
Каталитич. цикл конверсии в-ва S (субстрата) в продукт P под действием фермента E протекает с образованием промежут. соед. Xi:

где ki - константы скорости отдельных элементарных стадий, <kS -></k константа равновесия образования фермент-субстратного комплекса X1 (ES, комплекс Михаэлиса).
При данной т-ре скорость р-ции зависит от концентраций фермента, субстрата и состава среды. Различают стационарную, предстационарную и релаксационную кинетику ферментативных р-ций.
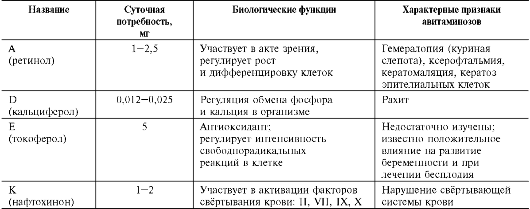
Стационарная кинетика. В стационарном состоянии по промежуточным соед. (dXi/dt = 0, i = 1, ..., n) и при избытке субстрата  , где [S]0 и [E]0 - начальные концентрации соотв. субстрата и фермента, кинетика процесса характеризуется постоянным, неизменным во времени уровнем концентраций промежут. соед., а выражение для скорости процесса v0, наз. начальной стационарной скоростью, имеет вид (ур-ние Михаэлиса- Ментен):
, где [S]0 и [E]0 - начальные концентрации соотв. субстрата и фермента, кинетика процесса характеризуется постоянным, неизменным во времени уровнем концентраций промежут. соед., а выражение для скорости процесса v0, наз. начальной стационарной скоростью, имеет вид (ур-ние Михаэлиса- Ментен):
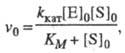 (1)
(1)
где значения k кат и К м -> ф-ции констант скорости элементарных стадий и заданы ур-нениями:
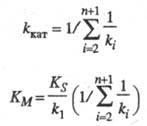
Величину k катназ. эффективной каталитич. константой скорости процесса, параметр К м -> константой Михаэлиса. Значение k кат определяется величинами <ki </kнаиб. медленных стадий каталитич. р-ций и иногда наз. числом оборотов фермента (ферментной системы); k катхарактеризует число каталитич. циклов, совершаемых ферментной системой в единицу времени. Наиб. распространены ферменты, имеющие значение k кат. для специфич. субстратов в диапазоне 102-103 с -1. Типичные значения константы Михаэлиса лежат в интервале 10-3- 10-4 M.
При больших концентрациях субстрата, когда 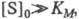
 т. е. скорость р-ции не зависит от концентрации субстрата и достигает постоянной величины, наз. макс. скоростью. Графически ур-ние Михаэлиса - Ментен представляет собой гиперболу. Его можно линеаризовать, используя метод двойных обратных величин (метод Лайнуи-вера - Берка), т. е. строя зависимость 1/vот 1/[S]0, или др. методы. Линейная форма ур-ния (1) имеет вид:
т. е. скорость р-ции не зависит от концентрации субстрата и достигает постоянной величины, наз. макс. скоростью. Графически ур-ние Михаэлиса - Ментен представляет собой гиперболу. Его можно линеаризовать, используя метод двойных обратных величин (метод Лайнуи-вера - Берка), т. е. строя зависимость 1/vот 1/[S]0, или др. методы. Линейная форма ур-ния (1) имеет вид:
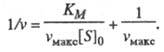 (2)
(2)
Она позволяет определить графически значения К м и v макс (рис. 1).
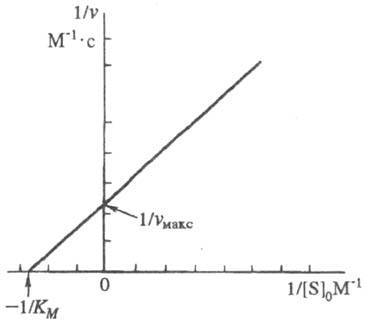
Рис. 1. График линейной трансформации ур-ния Михаэлиса - Ментен в двойных обратных величинах (по Лайнуиверу - Берку).
Величина К м > численно равна концентрации субстрата, при к-рой скорость р-ции равна 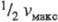 , поэтомуК м часто служит мерой сродства субстрата и фермента, однако это справедливо лишь, если
, поэтомуК м часто служит мерой сродства субстрата и фермента, однако это справедливо лишь, если 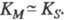
Величины К м > и <vm</v изменяются в зависимости от значений рН. Это связано со способностью участвующих в катализе групп молекулы фермента изменять свое состояние ионизации и, тем самым, свою каталитич. эффективность. В простейшем случае изменение рН приводит к протонированию или депротонированию, по крайней мере, двух ионизирующихся групп фермента, участвующих в катализе. Если при этом только одна форма фермент-субстратного комплекса (напр., ESH) из трех возможных (ES, ESH и ESH2) способна превращаться в продукт р-ции, то зависимость скорости от рН описывается ф-лой:
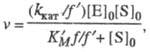
где f = 1 + <[H+]/K а + Kb/[H+] и f ' = 1 + <[H+]/К' а >+ K'b/>[H+] -т. наз. рН-ф-ции Михаэлиса, а К а, К b и К'a, K'b->константы ионизации групп аи bсоотв. своб. фермента и фермент-субстратного комплекса. В координатах lg<kкат</k - рН эта зависимость представлена на рис. 2, причем тангенсы углов наклона касательных к восходящей, независимой от рН, и нисходящей ветвям кривой должны быть равны соответственно +1, 0 и -1. Из такого графика можно определить значения рК а групп, участвующих в катализе.
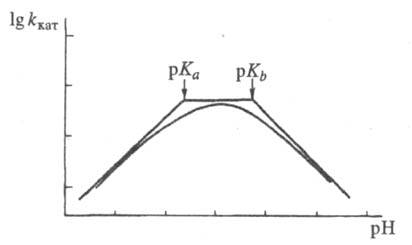
Рис. 2. Зависимость каталитич. константы от рН в логарифмич. координатах.
Скорость ферментативной р-ции не всегда подчиняется ур-нию (1). Один из часто встречающихся случаев - участие в р-ции аллостерич. ферментов (см. Регуляторы ферментов), для к-рых зависимость степени насыщения фермента от [S]0 имеет негиперболич. характер (рис. 3). Это явление обусловлено кооперативностью связывания субстрата, т. е. когда связывание субстрата на одном из участков макромолекулы фермента увеличивает (положит. кооперативность) или уменьшает (отрицат. кооперативность) сродство к субстрату др. участка.
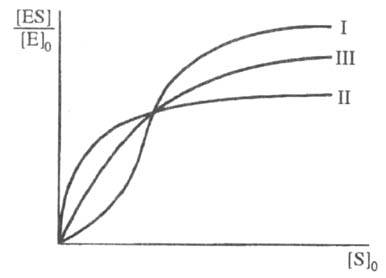
Рис. З Зависимость степени насыщения фермента субстратом от концентрации субстрата при положительной (I) и отрицательной (II) кооперативности, а также в ее отсутствии (III).
Предстационарная кинетика. При быстром смешении р-ров фермента и субстрата в интервале времен 10-6-10-1 с можно наблюдать переходные процессы, предшествующие образованию устойчивого стационарного состояния. В этом предстационарном режиме при использовании большого избытка субстрата  система дифференц. ур-ний, описывающая кинетику процессов, линейна. Решение данного типа системы линейных дифференц. ур-ний дается суммой экспоненциальных членов. Так, для кинетич. схемы, представленной выше, кинетика накопления продукта имеет вид:
система дифференц. ур-ний, описывающая кинетику процессов, линейна. Решение данного типа системы линейных дифференц. ур-ний дается суммой экспоненциальных членов. Так, для кинетич. схемы, представленной выше, кинетика накопления продукта имеет вид:
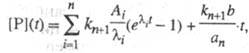
где Ai->, b, а n -> ф-ции элементарных констант скорости; 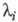 -корни соответствующего характеристич. ур-ния.
-корни соответствующего характеристич. ур-ния.
Величина, обратная 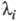 , наз. характеристич. временем процесса:
, наз. характеристич. временем процесса:
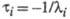
Для р-ции, протекающей с участием nпромежут. соед., можно получить nхарактеристич. времен.
Исследование кинетики ферментативной р-ции в предстационарном режиме позволяет получить представление о детальном механизме каталитич. цикла и определить константы скорости элементарных стадий процесса.
Экспериментально кинетику ферментативной р-ции в предстационарном режиме исследуют с помощью метода остановленной струи (см. Струевые кинетические методы), позволяющего смешивать компоненты р-ции в течение 1 мс.
Релаксационная кинетика. При быстром возмущающем воздействии на систему (изменение т-ры, давления, электрич. поля) время, к-рое необходимо системе для достижения нового равновесия или стационарного состояния, зависит от скорости процессов, определяющих каталитич. ферментативный цикл.
Система ур-ний, описывающая кинетику процесса, линейна, если смещение от положения равновесия невелико. Решение системы приводит к зависимостям концентраций компонентов разл. стадий процесса в виде суммы экспоненциальных членов, показатели экспонент к-рых имеют характер времен релаксаций. Результатом исследования является спектр времен релаксации, соответствующий числу промежут. соед., участвующих в процессе. Величины времен релаксаций зависят от констант скорости элементарных стадий процессов.
Релаксационные методы кинетики позволяют определить константы скорости отдельных элементарных стадий трансформации интермедиатов. Методы изучения релаксационной кинетики имеют разл. разрешающую способность: поглощение ультразвука - 10-6-10-10с, температурный скачок - 1O-4-10-6 с, метод электрич. импульса - 10-4-10-6 с, скачок давления - 10-2 с. При исследовании кинетики ферментативных р-ций наиб, применение нашел метод температурного скачка.
Макрокинетика ферментативных процессов. Развитие методов получения гетерогенных катализаторов путем иммобилизации ферментов на разл. носителях (см. Иммобилизованные ферменты )обусловило необходимость анализа кинетики процессов с учетом массопереноса субстрата. Теоретически и экспериментально исследованы закономерности кинетики р-ций с учетом эффектов диффузионного слоя и для систем с внутридиффузионными затруднениями при распределении фермента внутри носителя.
В условиях, когда на кинетику процесса влияет диффузионный перенос субстрата, каталитич. эффективность системы уменьшается. Фактор эффективности 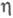 равен отношению плотности потока продукта в условиях протекания ферментативной р-ции с диффузионно пониженной концентрацией субстрата к потоку, к-рый мог бы реализоваться в отсутствие диффузионных ограничений. В чисто диффузионной области, когда скорость процесса определяется массопереносом субстрата, фактор эффективности для систем с внешнедиффузи-онным торможением обратно пропорционален диффузионному модулю
равен отношению плотности потока продукта в условиях протекания ферментативной р-ции с диффузионно пониженной концентрацией субстрата к потоку, к-рый мог бы реализоваться в отсутствие диффузионных ограничений. В чисто диффузионной области, когда скорость процесса определяется массопереносом субстрата, фактор эффективности для систем с внешнедиффузи-онным торможением обратно пропорционален диффузионному модулю  :
:
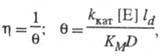
где <ld - ></l толщина диффузионного слоя, D - коэф. диффузии субстрата.
Для систем с внутридиффузионным торможением в р-циях первого порядка
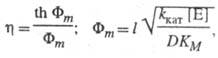
где Ф т - безразмерный модуль (модуль Тиле).
При анализе кинетич. закономерностей в ферментативных реакторах широкое теоретич. и эксперим. развитие получили "идеальные" модели реакторов, проточный безградиентный реактор (проточный реактор идеального перемешивания), проточный реактор с идеальным вытеснением, мембранный реактор.
Кинетика полиферментных процессов. В организме (клетке) ферменты действуют не изолированно, а катализируют цепи трансформации молекул. Р-ции в полиферментных системах с кинетич. точки зрения можно рассматривать как последоват. процессы, специфич. особенностью к-рых является катализферментами каждой из стадий:
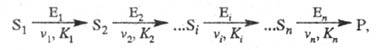
где <vi</v, <ki -></k соотв. макс, скорость процесса и константа Михаэлиса i -й стадии р-ции соответственно.
Важная особенность процесса - возможность образования устойчивого стационарного состояния. Условием-его возникновения может служить неравенство <vi</v > v0, где v0 - скорость лимитирующей стадии, характеризуемой наименьшей константой скорости и тем самым определяющей скорость всего последоват. процесса. В стационарном состоянии концентрации метаболитов после лимитирующей стадии меньше константы Михаэлиса соответствующего фермента.
Специфич. группу полиферментных систем составляют системы, осуществляющие окислит.-восстановит. р-ции с участием белковых переносчиков электронов. Переносчики образуют специфич. структуры, комплексы с детерминированной последовательностью переноса электрона. Кинетич. описание такого рода систем рассматривает в качестве независимой переменной состояния цепей с разл. степенью заселенности электронами.
Применение. Ф. р. к. широко используют в исследовательской практике для изучения механизмов действия ферментов и ферментных систем. Практически значимая область науки о ферментах - инженерная энзимология, оперирует понятиями Ф. р. к. для оптимизации биотехнол. процессов.
Дата добавления: 2017-01-13; просмотров: 7294;
