Металлы Неметаллы Оксиды Основания Кислоты Соли
Свойства химических соединений в первую очередь определяются их составом, поэтому надо четко разбираться в закономерностях составления химических формул, отражающих этот состав. При изучении отдельных классов неорганических соединений надо знать определение каждого класса, классификацию, способы получения и свойства. Оксиды.Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. В оксидах атомы кислорода соединяются только с атомами других элементов и не связаны между собой. Названия оксидов элементов, имеющих постоянную степень окисления, составляются из двух слов «оксид + название элемента в родительном падеже»: MgO - оксид магния, Na2O - оксид натрия, СаО - оксид кальция.Если элемент образует несколько оксидов, то после названия элемента указывается его степень окисления римской цифрой в скобках: МnО - оксид марганца (II), Мn2О3 - оксид марганца (III).Название оксидов можно также образовывать добавлением к слову "оксид" греческих числительных. Например, СО2 - диоксид углерода, SO2 - диоксид серы, SO3 - триоксид серы, OsO4 - тетраоксид осмия.По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие. Оксиды, которые при химических реакциях образуют соли, называются солеобразующими: СО2 + Са(ОН)2 = СаСО3 + Н2О оксид углерода (IV) гидроксид кальция карбонат кальция MgO + 2НС1 = MgCl2 + Н2О оксид магния хлороводородная кислота хлорид магния СО2 и MgO - солеобразующие оксиды. Оксиды, которые не образуют солей, называются несолеобразующими: NO - оксид азота (II), N2O - оксид азота (I), SiO - оксид кремния (II) - это несолеобразующие оксиды. Солеобразующие оксиды делятся на основные, кислотные и амфотерные.К основным оксидам относятся только оксиды металлов: щелочных (Li, Na, К, Rb, Cs, Fr), щелочноземельных (Mg, Ca, Sr, Ba, Ra), лантана, а также всех остальных металлов в их низших степенях окисления. Например, Na2O, CaO, Cu2O, CrO, MnO, BaO, La2O3 - основные оксид. Гидраты всех основных оксидов являются основаниями:
| Na2O → NaOH | СаО | → Са(ОН)2. |
| оксид основание | оксид | основание |
| натрия гидроксид | кальция | гидроксид |
| натрия | кальция |
К кислотным оксидам относятся оксиды неметаллов, а также металлов в высших степенях окисления. Например, SO2, SO3, СО2, СrО3, Мn2О7 - кислотные оксиды. Гидраты всех кислотных оксидов являются кислотами:
| SO2 → Н2SO3 | N2О5 → | НNO3 |
| оксид сернистая | оксид | азотная |
| cеры (IV) кислота | азота (V) | кислота |
К амфотерным оксидам относятся оксиды некоторых металлов главных подгрупп (оксиды бериллия, алюминия), а также оксиды некоторых металлов побочных подгрупп периодической системы элементов Д. И. Менделеева в промежуточных степенях окисления. Например, BeO, A12O3, ZnO, MnO3, Fe2O3, Cr2O3 - амфотерные оксиды. Гидроксиды амфотерных оксидов проявляют свойства кислот и оснований: Zn(OH)2 ← ZnO → H2ZnO2 гидроксид цинка оксид цинка цинковая кислота
Составление формул оксидов. При составлении формул оксидов рекомендуем придерживаться следующего плана (на примере оксида азота (III)): 1) записать химические знаки элементов, входящих в состав вещества, и указать их степени окисления: N+3 O-2 2) найти наименьшее общее кратное степеней окисления: 3 x 2 = 6 3) определить индексы элементов, разделив наименьшее общее кратное на модуль степени окисления каждого элемента: 6 : 3 = 2; 6 : 2 = 3. 4) полученные индексы приписать справа к знакам элементов: N2O3. Основания.Основания – это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп (OH-). Например, Fe(OH)3, Ca(OH)2 . Названия оснований складывается из слов «гидроксид» и названия металла в родительном падеже: Ва(ОH)2 – гидроксид бария; NaOH – гидроксид натрия. Если металл образует несколько гидроксидов, то указывают степень его окисления римской цифрой в скобках. Например, Fe(ОН)2 - гидроксид железa (II), Bi(OH)3 - гидроксид висмута (III). Haзвание основания составляют и так: к слову гидроксид добавляют приставки, которые показывают количество гидроксогрупп в основании. Например, Са(ОН)2 - дигидроксид кальция, Вi(ОН)3 - тригидроксид висмута. Число гидроксогрупп в молекуле основания определяет его кислотность. В зависимости от числа протонов, которые может присоединить основание, различают: 1) однокислотные (NaOH, КОН, NH4OH), 2) двухкислотные (Ca(OH)2, Sr(OH)2, Ва(OH)2), 3) трехкислотные (La(OH)3, Bi(OH)3) и т.д. основания. Остатки оснований.Положительно заряженные группы атомов (катионы), которые остаются после отрыва от молекулы основания одной или нескольких гидроксогрупп, называются остатками основания. Величина положительного заряда остатка основания определяется числом оторвавшихся гидроксогрупп. В табл. 1 приведены формулы и названия некоторых оснований и их остатков. Таблица 1 - Названия и формулы некоторых оснований и их остатков (по номенклатуре ИЮПАК)
| Формула основания | Название основания | Остаток основания | Название остатка |
| NaОН | Гидроксид натрия | Na+ | Натрий-ион |
| NH4OH | Гидроксид аммония | NH4+ | Аммоний-ион |
| Mg(ОН)2 | Гидроксид магния | MgOH+ Mg2+ | Гидроксомагний-ион Магний-ион |
| Bi(OH)3 | Гидроксид висмута (III) | Bi(OH) + Bi(OH)2+ Bi3+ | Дигидроксовисмут (III) - ион Гидроксовисмут (III)-ион Висмут (III)-ион |
| Mn (OH)2 | Гидроксид марганца (II) | MnOH+ Mn2+ | Гидроксомарганец (II)-ион Марганец (II)-ион |
Амфотерные гидроксиды. Амфотерными называются такие гидроксиды, которые в зависимости от условий проявляют основные и кислотные свойства. Например: Zn(OH)2 + 2HCI = ZnCl2 + 2H2O Zn(OH)2 + 2H+ = Zn2+ + 2H2O Zn(OH)2 + 2NaOH = [Na2[Zn(OH)4] Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O в растворе тетрагидроксоцинкат натрия при сплавлении цинкат натрия С позиций теории электролитической диссоциации, амфотерными называются гидроксиды, которые при диссоциации образуют и катионы водорода, и гидроксид-ионы. К амфотерным гидроксидам относятся гидроксиды некоторых металлов главных подгрупп (бериллия, алюминия), а также некоторых металлов побочных подгрупп периодической системы элементов в промежуточных степенях окисления. Например, Ве(ОН)2, А1(ОН)3, Zn(OH)2, Ge(OH)2, Sn(OH)4, Fe(OH)3, Cr(OH)3 - амфотерные гидроксиды. Кислоты. Кислотами называют сложные соединения, в состав которых входят атомы водорода, способные замещаться атомами металла. Кислоты различают: 1) по наличию или отсутствию кислорода в составе кислоты: а) бескислородные (это водные растворы водородных соединений неметаллов VI и VII групп периодической системы элементов H2S, Н2Те, HF, HC1, HBr, HI, а также HSCN и HCN); б) кислородсодержащие (это гидраты оксидов неметаллов, а также некоторых металлов в высших степенях окисления (+5, +6, +7) - Н2СО3, H2SO4, Н2СlO4 и т.д.); 2) по основности(т.е. по числу атомов водорода в молекуле кислоты, способных замещаться атомами металлов с образованием соли) а) одноосновные (НС1, HNO3, HCN, CH3COOH), б) двухосновные (H2S, H2SO4, H2CO3), в) трехосновные (Н3РО4, H3AsO4) и т.д.
Названия бескислородных кислот составляют из названия элемента + О + слово "водородная": НС1 - хлороводородная кислота; H2S - сероводородная кислота; HCN - циановодородная кислота; HI - йодоводородная кислота. Названия кислородных кислот производятся от названия неметалла с прибавлением –ная, - вая, если степень окисления неметалла равна номеру группы. По мере понижения степени окисления суффиксы меняются в следующем порядке : -оватая; - истая; - оватистая: HCIO4 – хлорная кислота; HCIO2 – хлористая кислота; HCIO3 – хлорноватая кислота; HCIO − хлорноватистая кислота; HNO3 − aзотная; HNO2 – азотистая; H2SO4 − серная; H2SO3 – сернистая. Анионы кислоты. Отрицательно заряженные группы атомов и одиночные атомы (отрицательные ионы), которые остаются после отрыва от молекулы кислоты одного или нескольких атомов водорода, называются анионами кислоты. Величина отрицательного заряда аниона кислоты определяется числом атомов водорода, замещенных металлом (табл. 2). Соли. Соли – это продукты замещения водорода кислоты металлом или гидроксогрупп основания кислотными остатками. Например, 2НСl + Zn = ZnCl2 + H2 Н2SO4 + 2NaOH = Na2SO4 + 2H2O кислота соль кислота основание соль С позиций теории электролитической диссоциации, соли - это электролиты, при диссоциации которых образуются катионы,отличные от катионов водорода, и анионы, отличные от анионов ОН- .
Таблица 2 - Названия и формулы некоторых кислотных остатков
| Формула кислоты | Название кислоты | Анион | Название аниона | |
| НС1 | Хлороводородная (соляная) | Сl- | Хлорид-ион | |
| НВr | Бромоводородная | Вr- | Бромид-ион | |
| HI | Йодоводородная | I | Йодид-ион | |
| H2S | Сероводородная | HS– S2– | Гидросульфид-ион Сульфид-ион | |
| HClO | Хлорноватистая | ClO– | Гипохлорит-ион | |
| HClO2 | Хлористая | ClO2- | Хлорит-ион | |
| НСlO3 | Хлорноватая | СlO3- | Хлорат-ион | |
| HClO4 | Хлорная | ClO4- | Перхлорат-ион | |
| H2SO3 | Сернистая | HSO3– SO32– | Гидросульфит-ион Сульфит-ион | |
| H2SO4 | Серная | HSO4- SO42− | Гидросульфат-ион Сульфат-ион | |
| HNO2 | Азотистая | NO2− | Нитрит-ион | |
| HNO3 | Азотная | NO3− | Нитрат-ион | |
| H3PO4 | Ортофосфорная | н2ро4- нро42- ро43- | Дигидрофосфат-ион Гидрофосфат-ион Ортофосфат-ион | |
| H2CO3 | Угольная | НСО3- СО32- | Гидрокарбонат-ион Карбонат-ион | |
| H2SiO3 | Кремниевая | HSiO3- SiO32- | Гидросиликат-ион Силикат-ион | |
| HMnO4 | Марганцовая | МnО4- | Перманганат-ион | |
| H3BO3 | Борная (ортоборная) | ВО33- | Борат-ион | |
| Н2СrO4 | Хроматы | СrO42- | Хромат-ион | |
| H2Cr2O7 | Дихромовая | Cr2O72- | Дихромат-ион | |
| HCN | Циановодородная | CN− | Цианид-ион |
Соли принято делить на средние, кислые и основные. Средняя соль — это продукт полного замещения водорода кислоты металлом или гидроксогруппы основания кислотным остатком. Например, Na2SO4, Са(NО3)2 - средние соли. Кислая соль - продукт неполного замещения водорода многоосновной кислоты металлом. Например, NaHSO4, Са(НСО3)2 - кислые соли. Основная соль — продукт неполного замещения гидроксогрупп многокислотного основания кислотными остатками. Например, Mg(OH)NO3, Al(OH)Cl2 - основные соли. Если атомы водорода в кислоте замещаются атомами разных металлов или гидроксогруппы оснований замещаются различными кислотными остатками, то образуются двойные соли. Например, KA1(SO4)2, Са(ОС1)С1. Двойные соли существуют только в твердом состоянии. Комплексные соли - это соли, в состав которых входят комплексные ионы. Например, соль K4[Fe(CN)6] - комплексная, так как в ее состав входит комплексный ион [Fe(CN)6]4-. Составление формул солей.При составлении формул солей нужно помнить правило: абсолютная величина произведения зарядов катионов на их число равна абсолютной величине произведения заряда кислотного остатка на число кислотных остатков. Например, для составления формулы карбоната натрия: 1) записывают катион и рядом анион из таблиц 1 и 2: Na+ CO32-; 2) находят наименьшее общее кратное модулей зарядов: 1х2=2; 3) делят общее кратное на модуль заряда катиона и получают их число (индекс): 2/1=2. Также находят число анионов: 2/2=1; 4) проставляют индексы и получают формулу Na2CO3. Название солей образуется из названия кислотного остатка (табл.2) в именительном падеже и названия катиона (табл. 1) в родительном падеже (без слова «ион»): NaCI – хлорид натрия; FeS - сульфид железа (II); NH4CN - цианид аммония. Окончания названий анионов кислородсодержащих кислот зависят от степени окисления кислотообразующего элемента:
| Окончание названия кислоты | Название аниона |
| -ная, -овая | -ат |
| -истая | -ит |
| -оватистая | гипо- + -ит |
Например, CaCO3 – карбонат кальция; Fe2(SO3)3- сульфит железа (III). Названия кислых и основных солей образуются по тем же общим правилам, что и названия средних солей. При этом название аниона кислой соли снабжают приставкой гидро-,указывающей на наличие незамещенных атомов водорода (число атомов водорода указывают греческими числительными приставками). Катион основной соли получает приставку гидроксо-,указывающую на наличие незамещенных гидроксогрупп. Например, СаНРО4 – гидроортофосфат кальция; (MgOH)2SO4 - сульфат гидроксомагния; NaHCO3 - гидрокарбонат натрия; КА1(SO4)2 - сульфат калия-алюминия. Генетические связи.Генетические связи - это связи между разными классами, основанные на их взаимопревращениях. Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент. Среди металлов можно выделить две разновидности рядов:
1. Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений: металл– основный оксид–щёлочь–соль, например генетический ряд калия K – K2O –KOH–KCl.
2. Генетический ряд, где в качестве основания выступает нерастворимое основание. Данный ряд можно представить цепочкой превращений: металл–основный оксид–соль–нерастворимое основание–основный оксид–металл. Например: Cu – CuO – CuCl2 – Cu(OH)2 – CuO – Cu.
Среди неметаллов также можно выделить две разновидности рядов:
1. Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде: неметалл–кислотный оксид–растворимая кислота–соль. Например: P – P2O5 – H3PO4 – Na3PO4.
2. Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота: неметалл – кислотный оксид – соль – кислота –кислотный оксид – неметалл. Например:
Si – SiO2 – Na2SiO3 – H2SiO3 – SiO2 – Si. При изучении химических свойств различных классов неорганических соединений необходимо помнить, что взаимодействовать друг с другом могут только вещества, относящиеся к различным генетическим рядам (металла и неметалла), что отражено схемой:
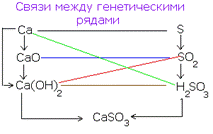
2.3 Семинар № 1. «Способы получения и химические свойства оксидов, кислот, оснований, солей»Цель: отработка навыков составления молекулярных и структурных формул веществ, составления названий и определения принадлежности соединений к определенным классам. Вопросы для обсуждения и задания: 1.Какие вещества называют оксидами? Составьте формулы и дайте названия оксидов следующих элементов:а) калия; б) цинка; в) фосфора (III); г) кремния (IV); д) хрома (VI); е) хлора (VII); ж) ртути (II).2.Изобразите графически формулы следующих оксидов: а) оксида меди (I); б) оксида фосфора (V); в) оксида серы (VI); г) оксида марганца (VII); д) оксида азота (III).3. Приведите примеры несолеобразующих оксидов.Какие оксиды называются: а) основными; б) кислотными; в) амфотерными? Приведите примеры всех видов оксидов.4.Как зависит характер оксида от положения элемента в периодической системе элементов Д.И. Менделеева? Ответ проиллюстрируйте примерами.5. Какие из следующих соединении будут реагировать с оксидом серы (VI): P2O3, СаО, НNO3, Ва(ОН)2, MgO, H2O, SO2? Напишите уравнения возможных реакций.6. Cоставьте формулы оксидов и их гидратов для следующих элементов: железа (III), марганца (II, VII), серы (IV, VI), хлора (I, VII). Назовите гидроксиды.7. Составьте уравнения реакций между: а) оксидом кальция и оксидом фосфора (V); б) оксидом железа (III) и оксидом серы (VI); в) гидроксидом калия и оксидом цинка; г) серной кислотой и оксидом цинка; д) ортофосфорной кислотой и оксидом цинка. 8. Какие соединения называются основаниями? Чем определяется кислотность оснований? Что называется остатком основания? Приведите примеры. 9. Напишите названия и графические изображения формул следующих оснований и их остатков: Ва(ОН)2, КОН, Cа(ОН)2, La(OH)3, Th(OH)4. 10. Какие основания являются щелочами? Как щелочи изменяют цвет индикаторов? 11. Какая реакция называется реакцией нейтрализации? Напишите уравнения реакций между следующими соединениями (со всеми возможными продуктами): а) гидроксидом калия и азотной кислотой; б) гидроксидом калия и хлоридом никеля (II), в) тригидроксидом висмута и серной кислотой; г) гидроксидом калия и оксидом кремния (IV); д) гидроксидом натрия и сульфатом магния; ж) гидроксидом калия и хлоридом цинка. 12. Напишите уравнения реакций, при помощи которых можно осуществить превращения: а) К → КОН; б) FeSO4 → Fe(OH)2; в) Са(ОН)2 → СаСО3. 13. Какие соединения называются кислотами? Чем определяется основность кислоты? Что называется кислотным остатком и чем определяется его заряд? 14. Напишите формулы оксидов, которые соответствуют кислотам: ортоборной Н3ВО3, марганцовой НMnО4, ортофосфорной Н3РО4. 15. Напишите уравнения реакций разбавленной серной кислоты: а) с алюминием; б) с оксидом магния; в) с гидроксидом железа (III); г) с нитратом бария. Что общего в этих реакциях? 16.Напишите уравнения реакций, с помощью которых можно получить:а) серную кислоту Н2SО4; б) сероводородную кислоту H2S; в) угольную кислоту Н2СО3.17. Какие из следующих металлов вытесняют водород из хлороводородной кислоты: К, Ва, Hg, Fe, Сu, Al, Ag, Na, Mg, Au? Составьте уравнения реакций. 18. Какие соединения называются солями? Какие соли вы знаете?Составьте формулы солей из следующих остатков: а) гидроксомагний-ион иортофосфат-ион; б) гидроксовисмут(III)-ионисульфат ион; в) гидроксовисмут (III)-ион и нитрат-ион; г) висмут(III)-ион и xлорид-ион; д) никель(II)-ион и ортофосфат-ион.19.Дайте названия следующим солям и изобразите графические формулы: MgCl2, Na2SO4, K3PO4, Cu(NO3)2, BaCO3, Fe(NO3)3 FeS, KHCO3, Na2HPO4, NaH2PO4, Fe(OH)Cl.20.Напишите формулы следующих солей: а) сульфат железа (III); б) дигидрофосфат магния; в) хлорид гидроксоалюминия. 21. Какие из следующих веществ взаимодействуют между собой: оксид меди (II), серная кислота, гидроксид кальция, оксид углерода (IV), гидроксид цинка, гидроксид натрия? Напишите уравнения реакций. 22. С соединениями каких классов взаимодействуют металлы? Напишите уравнения соответствующих реакций. 24. При взаимодействии соединений каких классов образуются соли? Напишите уравнения соответствующих реакций. Индивидуальное задание: Для заданной преподавателем соли указать: - название соли; - формулы гидроксидов, ее образовавших, их названия, степень окисления гидроксидообразующего элемента; - формулы оксидов для вышеприведенных гидроксидов, их характер; - уравнения диссоциации гидроксидов (общее и по ступеням): а) основания б) кислоты в) для амфотерных гидроксидов уравнения диссоциации по типу кислоты, и по типу основания; - уравнения реакции получения соли в молекулярном и ионном виде; - графическую формулу соли; - определите значения эквивалентов гидроксидов и соли. Варианты заданий: AlCl3, KNO3, KBr, Na3PO4, Na2CO3, CaCl2, KMnO4, NaClO, KClO3, KClO4, Cr(NO3)3, Zn(NO3)2, K2ZnO2, KAlO2, Na2SO3, Na2S, LiHS, KCN,K2CO3, KHCO3, NaHCO3, (CuOH)2CO3, AlOHCl2 Предлагаемый алгоритм выполнения: - формула соли Al2(SO4)3, ее название – сульфат алюминия - данная соль образована гидроксидом алюминия Al(OH)3, и серной кислотой Н2SO4. Cпень окисления кислотообразующего элемента (серы) +6 - формулы оксидов и их характер: оксид алюминия Al2O3 проявляет амфотерные свойства; оксид серы (VI) SO3 – кислотный оксид. - уравнения диссоциации гидроксидов (общее и по ступеням): а) основания по типу основания: Al(OH)3«Al3+ +3OH- - общее по ступеням: 1) Al(OH)3«Al(OH)2++OH- 2) Al(OH)2+«AlOH2++OH- 3) AlOH+«Al3++OH- по типу кислоты: H3AlO3 « H2O + HAlO2 Ортоформа метаформа – более устойчивая HAlO2«H+ + AlO2- б) кислоты: H2SO4«2H++SO4 2- - общее по ступеням: 1) H2SO4«H++HSO4- 2) HSO4-«H++SO4 2- - реакции образования: а) в молекулярном виде 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2Oб) в полном ионном 2Al(OH)3 +6H+ +3SO42- = 2Al3+ + 3SO42- + 6H2O в) в сокращенном ионном 2Al(OH)3 +6H+ = 2Al3+ + 6H2O - графическая формула соли


 O O
O O
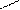 S
S
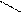 Al — O O
Al — O O
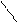


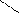
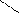
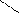
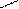
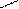
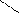
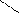
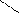
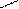
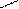
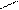
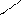 O O S O O Al O O S O O - эквивалент гидроксида алюминия равен 1/3 молекулы, серной кислоты ½ молекулы, а соли 1/6 молекулы.
O O S O O Al O O S O O - эквивалент гидроксида алюминия равен 1/3 молекулы, серной кислоты ½ молекулы, а соли 1/6 молекулы.
2.5 Тесты для самоконтроля Тест 1 1. Молярная масса гидросульфида натрия равна: 1) 56 2) 64 3) 74 4) 87 2. Какие из оксидов, формулы которых приведены ниже, не реагируют со щелочью? 1) СО2 2) А12О3 3) CuO 4) SiO2 3. В отличие от гидроксида калия гидроксид алюминия реагируем с: 1)хлоридом натрия 2) соляной кислотой 3) гидроксидом натрия (р-р) 4) серной кислотой 4. В каких парах соединения не реагируют между собой? 1)азотная кислота и гидроксид бария 2) гидроксид натрия и гидроксид цинка 3) гидроксид калия и хлорид железа (II) 4) гидроксид кальция и оксид натрия 5. С какими веществами не реагирует разбавленная серная кислота? 1)медью 2) гидроксидом меди (II) 3) оксидом меди (II 4) хлоридом меди (II) 6. Отметьте схемы реакций, в результате которых может получиться кислота: 1) SO3 + Н2О → 2) SiO2+ Н2О → 3) ВаС12 + H2SO4 (разб.) → 4) Na2SiO3 + HNO3 → 7. Гидросульфиту кальция отвечает формула: 1) Ca(HSO3)2 2) (CaOH)Cl 3) Ca(HS)2 4) CaHSO3. 8. Два типа кислых солей образует кислота: 1) угольная 2) сернистая 3) сероводородная 4) ортофосфорная 9. Сумма коэффициентов в молекулярном уравнении реакции Al(OH)3 + SO3 → средняя соль + … равна 1) 4 2) 5 3) 6 4) 9 10. Составьте краткое ионное уравнение реакции взаимодействия гидроксида железа (III) с избытком раствора соляной кислоты. Сумма коэффициентов равна 1) 3 2) 4 3) 6 4) 8
Тест 2
1. Отметьте символ элемента, образующего как кислотный, так и основный оксиды: 1) К 2) S 3) Сu 4) Мn 2. При внесении каких металлов в разбавленный раствор серной кислоты выделяется водород? 1)меди 2) железа 3) цинка 4) серебра 3. Сумма коэффициентов в молекулярном уравнении реакции KOH + H3P O4 → K2HPO4 + … равна: 1) 4 2) 5 3) 6 4) 7 4. Составьте краткое ионное уравнение реакции взаимодействия гидроксида магния с избытком раствора азотной кислоты. Сумма коэффициентов равна 1) 3 2) 5 3) 6 4)9 5. Гидросульфат калия взаимодействует по отдельности в растворе с веществами: 1)К2SO3, HCl, KOH 2) Zn, SiO2, BaCl2 3) CO2, K2CO3, NaOH 4) Mg, K2S, LiOH 6. В какой группе указаны формулы только щелочей? 1) NaOH, Са(ОН)2, Mg(OH)2 2) КОН, NH4OH, Сu(ОН)2 3) NaOH, КОН, Ва(ОН)2 4) LiОН, КОН, Fe(OH)2 7.Укажите формулу дигидроортофосфата кальция: 1) СаНРО4 2) Са3(РО4)2 3) Са(Н2РО4)2 4) Са2Р2О7 8.Каким кислотам, формулы которых приведены ниже, отвечает оксид фосфора (V)? 1) Н3РО4 2) НРО3 3) Н3РО2 4) Н4Р2О7 9. У каких солей заряд кислотного остатка равен -1: 1) сульфид натрия 2) гидросульфит кальция 3) дигидрофосфат натрия 4) гидросульфат калия 10. С какими веществами не реагирует разбавленная серная кислота? 1)медью 2) гидроксидом меди (II) 3) оксидом меди (II) 4) хлоридом меди (II)
Тема 3. «Химическая термодинамика. Энергетика химических процессов»3.1 Содержание программыОсновные понятия химической термодинамики.Первое начало термодинамики. Энтальпия системы.Термохимические расчеты. Закон Гесса.Второе начало термодинамики.Энтропия и ее статистическая интерпретация. Свободная энергия Гиббса.Направление химических процессов. Энтальпийный и энтропийный факторы. Критерий самопроизвольного протекания процесса.
Уровень теоретической и практической подготовки Студент должен знать важнейшие термодинамические понятия и законы. Студент должен уметь производить термохимические расчеты;предсказывать возможность и направление протекания реакций.
Дата добавления: 2017-01-13; просмотров: 6769;
