Методические рекомендации к теме
Основные понятия и законы химии
Содержание программы
Предмет и значение химии. Основные понятия и законы стехиометрии: моль, молярная масса, химический эквивалент, фактор эквивалентности, молярная масса эквивалента. Основные законы стехиометрии: закон постоянства состава, закон сохранения массы веществ, законы кратных и объемных отношений, газовые законы, закон эквивалентов.
В результате изучения темыстудент должен знать важнейшие химические понятия: вещество, химический элемент, атом, молекула, относительные атомная и молекулярная массы, химический эквивалент; основные законы стехиометрии: сохранения массы веществ, постоянства состава, эквивалентов. Студент должен уметь вычислять: массовую долю химического элемента по формуле соединения; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции; эквивалент и фактор эквивалентности. Студент должен владеть навыками взвешивания веществ на технических весах и работы с лабораторным оборудованием.
Методические рекомендации к теме
Химия - наука, изучающая состав, строение, свойства и превращение веществ. В современной жизни, особенно в производственной деятельности человека, химия играет исключительно важную роль. Нет почти ни одной отрасли производства, не связанной с применением химии. Химические процессы лежат в основе переработки природных материалов и получения металлов, удобрений, синтетического каучука, пластмасс, волокон, красителей, лекарств и т.д. Для химической переработки природного сырья необходимо знать общие законы превращения веществ. Важным разделом химии является стехиометрия, изучающая количественный состав веществ и соотношения между количествами реагентов и продуктов химических реакций. Количественные соотношения устанавливаются на основе понятия моль, являющегося единицей измерения количества вещества. Моль – количество вещества, содержащее столько же структурных единиц, сколько атомов содержится в 12 г углерода 12С. Масса одного моля вещества называется молярной массой (М). Молярная масса чаще всего выражается в г/моль и численно равна относительной молекулярной массе (Мr). Масса вещества m иколичество вещества n cвязаны соотношением: m = n · M (1)В основе стехиометрических расчетов лежат следующие законы:
§ сохранения массы веществ: общая масса веществ, вступающих в химическую реакцию, равна общей массе веществ, образующихся в результате реакции;
§ кратных отношений:
если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа;
§ постоянства состава: всякое чистое вещество молекулярного строения независимо от способов его получения имеет постоянный качественный и количественный состав;
§ простых объемных отношений:
при постоянном давлении и температуре объемы реагирующих между собой газов, а также объемы газообразных продуктов реакции относятся как небольшие целые числа;
§ Авогадро:
в равных объемах различных газов при одинаковых температурах и давлении содержится одинаковое число молекул;
из закона Авогадро следует:
1) при нормальных условиях 1 моль любого газа занимает объем 22,4 л. Нормальными условиями (сокращенно н.у.) для газов считают давление P0=101,3 кПа = 1 атм и температуру T0 = 273,15 К = 0 0С. Объем 1 моля газа называется молярным объемом (Vm) и чаще всего выражается в л/моль. Объем газа (V) и количество вещества (n) связаны соотношением:
V = n · Vm (2)
2) плотности двух газов при одинаковых условиях прямо пропорциональны их молярным массам:
ρ1 / M1 = ρ2 / M2 (3)
где ρ₁ и ρ₂ - плотности газов, M₁ и M₂ - молярные массы газов.
При решении задач часто пользуются относительными плотностями (D) газов, которые показывают во сколько раз один газ тяжелее другого. Так относительная плотность первого газа по второму можно рассчитать следующим образом:
D2(1)= ρ1 / ρ2 = M1 / M2. (4)
§ эквивалентов:
массы реагирующих веществ относятся между собой как молярные массы их эквивалентов.
Химический эквивалент – это реальная или условная химическая частица, эквивалентная одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. Число, показывающее, какая доля реальной частицы эквивалентна одному катиону водорода или одному электрону в окислительно-восстановительной реакции, называют фактором эквивалентности – fэкв. Фактор эквивалентности: 1) кислот равен единице, деленной на число замещенных катионов водорода. Так в реакции Н2SO4 + 2NaOH = Na2SO4 + 2H2O fэкв.(Н2SO4) = ½, а в реакции Н2SO4 + NaOH = NaНSO4 + H2O fэкв.(Н2SO4) = 1; 2) оснований равен единице, деленной на число замещенных гидроксид-ионов. В реакции Mg(ОН)2 + НСl = MgOHCl + H2O fэкв.[Mg(ОН)2] = 1; 3) соли равен единице, деленной на произведение числа катионов металла и их заряда. Так fэкв.[Са3(РО4)2] = 1/(3·2) = 1/6; 4) окислителя (восстановителя) равен 1, деленной на число принятых (отданных) электронов. Так в реакции каталитического окисления аммиака 4NH3 + 5O2 = 4NO + 6H2O степень окисления азота меняется с –3 до +2, так как молекула NH3 теряет 5 электронов fэкв.(NH3) = 1/5. Молярная масса эквивалента – масса 1 моль эквивалента. Она равна произведению фактора эквивалентности на молярную массу вещества. Например, молярная масса эквивалента аммиака в реакции его окисления вычисляется следующим образом: М(1/5NH3) = fэкв.(NH3) ·M(NH3); М(1/5NH3) = М(1/5NH3) = 1/5·17 = 3,4г/моль.
Исходя из изложенного можно сделать выводы: 1) фактор эквивалентности – величина переменная. Эквивалент одного и того же вещества может быть различным в зависимости от реакции, в которой участвует это вещество, 2) молярные массы эквивалентов одноосновных кислот и однокислотных оснований численно равны их молярным массам.
1.3 Примеры решения задач

 Пример 1.1. Вычислить массу 6,72 л кислорода при нормальных условиях (н.у.). Решение: V(O2) = 6,72 л 1) Вычисляем количество вещества кислорода по уравнению 2: m(O2) = ?
Пример 1.1. Вычислить массу 6,72 л кислорода при нормальных условиях (н.у.). Решение: V(O2) = 6,72 л 1) Вычисляем количество вещества кислорода по уравнению 2: m(O2) = ?
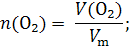
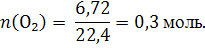
2) Молярную массу кислорода вычисляем как сумму молярных масс двух атомов кислорода до десятых долей: М(О2) = 16,0 +16,0 = 32,0 г/моль. 3) Находим массу кислорода по уравнению 1:
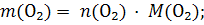
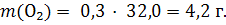

 Пример 1.2. Какой объем (н.у.) займут 51 г аммиака? Решение: m(NH3) = 51 г 1) Вычисляем молярную массу аммиака: V(NH3) = ? M(NH3) = 14,0 + 1,0 · 3 = 17,0 г/моль. 2) Находим количество вещества:
Пример 1.2. Какой объем (н.у.) займут 51 г аммиака? Решение: m(NH3) = 51 г 1) Вычисляем молярную массу аммиака: V(NH3) = ? M(NH3) = 14,0 + 1,0 · 3 = 17,0 г/моль. 2) Находим количество вещества:
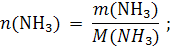
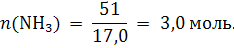
3) Определяем объем газа: V(NH)3 = n(NH)3 · Vm; V(NH)3= 3,0 · 22,4 = 67,2 л.

 Пример 1.3.Относительная плотность газа по воздуху равна 1,517. Вычислите молярную массу этого газа. Решение:Dвозд.(газа) = 1,58 Средняя молярная масса воздуха равна 29 г/моль. Молярную массу газа вычисляем по M(газа) = ? уравнению:
Пример 1.3.Относительная плотность газа по воздуху равна 1,517. Вычислите молярную массу этого газа. Решение:Dвозд.(газа) = 1,58 Средняя молярная масса воздуха равна 29 г/моль. Молярную массу газа вычисляем по M(газа) = ? уравнению: 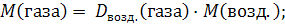
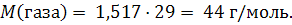
Пример 1.4. Какую массу и какой объем диоксида углерода можно получить при термическом разложении 50 г гидрокарбоната калия? Решение: m(KHСО3) = 50 г 1) Рассчитываем молярную массу гидрокарбоната калия и m(CO2) = ? и количество вещества: V(CO2) = ? M(KНСО3) = 39,1 +1,0 + 12,0 + 16,0 · 3 = 100,1 г/моль
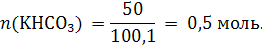 2)Составляем уравнение реакции: 2KНСО3 = К2СО3 + СО2 + Н2O. Из уравнения реакции видим, что при разложении 2 моль гидрокарбоната калия выделяется 1 моль диоксида углерода, т.е. количество вещества образовавшегося СО2 в два раза меньше, чем количество вещества разложившегося гидрокарбоната калия: n(СО2) = ½ n(KНCO3);
2)Составляем уравнение реакции: 2KНСО3 = К2СО3 + СО2 + Н2O. Из уравнения реакции видим, что при разложении 2 моль гидрокарбоната калия выделяется 1 моль диоксида углерода, т.е. количество вещества образовавшегося СО2 в два раза меньше, чем количество вещества разложившегося гидрокарбоната калия: n(СО2) = ½ n(KНCO3);


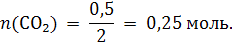
3) Для расчета массы образовавшегося диоксида углерода воспользуемся молярной массой этого вещества: m(СО2) = n(CO2) · M(CO2); m(СО2) = 0,25 · 44 = 11 г. 4) Объем вычисляем с использованием молярного объема газов: V(СО2) = n(CO2) · Vm; V(СО2) = 0,25 · 22,4 = 5,6 л.
Вычисление массовой доли химического элемента в соединении
Вычисления массовой доли элемента в соединении удобно производить с использованием уравнения: 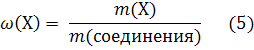
В данном случае массовая доля выражена в долях единицы. Чтобы получить массовую долю в процентах, следует пользоваться уравнением:
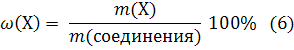

 Пример 1.5. Вычислите массовую долю калия (%) в ортофосфате калия. Решение: K3РО4 1) Вычисляем молярную массу ортофосфата калия: М(K3РО4) = 39,1 · 3 + 31,0 + 16,0 · 4 = 212,3 г/моль. ω(K) = ? 2) Из химической формулы ортофосфата калия следует, что 1 моль K3РО4 содержит 3 моль атомов калия. Массовую долю калия в ортофосфате калия вычисляем по уравнению:
Пример 1.5. Вычислите массовую долю калия (%) в ортофосфате калия. Решение: K3РО4 1) Вычисляем молярную массу ортофосфата калия: М(K3РО4) = 39,1 · 3 + 31,0 + 16,0 · 4 = 212,3 г/моль. ω(K) = ? 2) Из химической формулы ортофосфата калия следует, что 1 моль K3РО4 содержит 3 моль атомов калия. Массовую долю калия в ортофосфате калия вычисляем по уравнению:
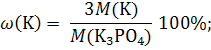
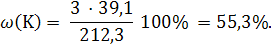

 Пример 1.6. Рассчитайте массовую долю калия (%) в пересчете на K2O в калийной селитре. Решение: KNO3 Калийная селитра или нитрат калия – это сложное удобрение, содержащее два элемента питания растений (калий и ω(K2O) = ? азот). В агрохимии принято выражать массовую долю элемента в пересчете на его оксид. Чтобы произвести такой пересчет, составим схему превращения оксида калия в нитрат калия и уравняем при помощи коэффициентов число атомов калия в левой и правой частях этой схемы: K2O → 2KNO3. Из этой схемы, следует, что одинаковое число атомов калия содержится в 1 моль оксида калия и 2 моль нитрата калия, поэтому расчет производим по уравнению:
Пример 1.6. Рассчитайте массовую долю калия (%) в пересчете на K2O в калийной селитре. Решение: KNO3 Калийная селитра или нитрат калия – это сложное удобрение, содержащее два элемента питания растений (калий и ω(K2O) = ? азот). В агрохимии принято выражать массовую долю элемента в пересчете на его оксид. Чтобы произвести такой пересчет, составим схему превращения оксида калия в нитрат калия и уравняем при помощи коэффициентов число атомов калия в левой и правой частях этой схемы: K2O → 2KNO3. Из этой схемы, следует, что одинаковое число атомов калия содержится в 1 моль оксида калия и 2 моль нитрата калия, поэтому расчет производим по уравнению:
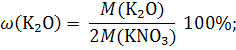
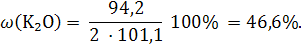
Расчеты эквивалента, фактора эквивалентности и молярной массы эквивалента.
Пример 1.7. Какая частица является эквивалентом ортофосфорной кислоты, если она нейтрализована гидроксидом калия до гидроортофосфата калия? Решение: 1) Составляем уравнение кислотно-основной реакции Н3РО4 + 2KОН = K2НРО4 + 2Н2О 2) Так как в реакцию вступило 2 катиона водорода из состава молекулы ортофосфорной кислоты, эквивалентом ее является условная частица ½ молекулы.
Пример 1.8. Рассчитайте молярную массу эквивалента гидроксида алюминия в реакции его полной нейтрализации азотной кислотой. Решение:1) Составляем уравнение кислотно-основной реакции Al(ОН)3 + 3HNO3 = Al(NO3)3 + 3Н2О 2) Определяем фактор эквивалентности. Из состава каждой формульной единицы Al(NO3)3 в реакцию вступают три гидроксид-иона OH-. Так как каждый гидроксид-ион взаимодействует с одним катионом водорода, эквивалентом гидроксида алюминия является условная частица 1/3 формульной единицы Al(OH)3, а фактор эквивалентности равен 1/3. 3) Рассчитываем молярную массу эквивалента по уравнению: М[1/3(Al(OH)3)] = fэкв.[Al(OH)3] · M.[Al(OH)3]; М[1/3(Al(OH)3)] = 1/3 · 78,0 г/моль = 26,0 г/моль.
Пример 1.9. Вычислить молярную массу эквивалента цинка в реакции взаимодействия его с серной кислотой. Решение:1) Составляем уравнение реакции: Zn + H2SO4 = ZnSO4 + Н2 2) Данная реакция окислительно-восстановительная, поэтому составляем электронное уравнение окисления цинка Zn0 – 2 ē → Zn+2 . 3) Так как атом цинка отдает 2 электрона, его фактор эквивалентности равен ½, а молярная масса эквивалента равна М(1/2Zn) = fэкв.(Zn) ·M(Zn); М(1/2Zn) = 1/2· 65,4 = 32,7 г/моль.
1.4 Практическое занятие № 1«Основные понятия стехиометрии и стехиометрические законы. Химический эквивалент»
Цель: отработка навыков проведения расчетовпоформулам веществ и уравнениям химических реакций, определения молярных масс эквивалентов химических соединений. Вопросы для обсуждения: 1.Сформулируйте основные положения атомно-молекулярного учения. 2. Дайте определение атома, молекулы, химического элемента, простого и сложного вещества. Приведите примеры.3.Сформулируйте законы сохранения массы веществ, постоянства состава, кратных отношений и простых объемных отношений.4. Какие вещества называются дальтонидами, и какие бертоллидами?5.Что такое моль, молярная масса, молярный объем газа? Чему равен молярный объем газа при нормальных условиях? 6. Приведите формулировки газовых законов. Как привести объем к нормальным условиям? 7. Что называется химическим эквивалентом? Фактором эквивалентности? 8. Как рассчитывают молярную массу эквивалента?
Упражнения и задачи для закрепления материала и отработки навыков: 1. Какую массу железа можно получить из 178 кг гематита, содержащего 90% оксида железа(III)? 2. Какой объем аммиака можно получить при взаимодействии 2,24 л азота и 1,12лводородаприн.у.? 3. Проиллюстрируйте расчетами действие закона кратных отношений на примере оксидов серы. 4. Проиллюстрируйте действие закона простых объемных отношений на примере реакции горения этана. 5. Вычислите массовую долю (%) калия в пересчете на К2О в хлориде калия 6. Какая частица является химическим эквивалентом серной кислоты, если она нейтрализована гидроксидом натрия до гидросульфата. 7. Рассчитайте молярную массу эквивалента гидроксида кальция в реакции его полной нейтрализации хлороводородной кислотой. 8. Вычислить молярную массу эквивалента алюминия в реакции взаимодействия его с хлороводородной кислотой.
1.5 Тесты самоконтроля Вариант 1 1. Молярная масса эквивалента карбоната натрия (г/моль) в реакции Na2CO3 + HCl = NaHCO3 + NaCl равна 1) 106 2) 53 3) 83 4) 41,5 2. Фактор эквивалентности сероводородной кислоты в реакции полной нейтрализации равен 1) 1 2) 1/2 3) 1/3 4) 2 3. Эквивалент оксида серы (IV) в реакции 2SO2 + О2 = 2SO3 равен 1) 2 молекулам 2) 1 молекуле 3) 1/2 молекулы 4) ¼ молекулы 4. При н.у. 5 моль водорода занимают объем (в литрах), равный 1) 11,2 2) 112 3) 22,4 4) 5,6 5. Газом, плотность которого по воздуху равна 1,59, является
1) N2 2) NO2 3) О2 4) NO 6. Плотность газа по водороду равна 22. Молярная масса газа равна
1) 44 2) 22 3) 11 4)0,7 7. 1 г кислорода при н.у. занимает объем (в литрах), равный
1) 0,7 2) 1,4 3) 22,4 4) 11,2 8. Масса 56 г железа соответствует количеству этого вещества (в молях), равному 1) 10 2) 1 3) 15 4) 12 9. При одинаковых условиях в сосудах находятся равные объемы кислорода и водорода. Каково соотношение масс газов 1) m(H2) = m(O2) 2) m(H2) >m(O2) 3) m(O2)> m(H2) 4) неопределенно 10. Каково соотношение объемов, занимаемых 2 моль азота и 2 моль аммиака при одинаковых условиях (Т и Р) 1) V(N2) > V(NH3) 2) V(N2) = V(NH3) 3) V(N2) < V(NH3) 4) неопределенно
Вариант 2 1. Молярная масса эквивалента ортофосфата калия (г/моль) в реакции K3РO4 + 2HCl = KH2PO4 + 2KCl равна 1) 212 2) 106 3) 70,7 4) 136 2. Фактор эквивалентности гидроксида железа(III) в реакции полной нейтрализации равен 1) 1 2) 1/2 3) 1/3 4) 2 3. Эквивалент серной кислоты в реакции Fe + H2SO4 = FeSO4 + H2 равен 1) 2 молекулам 2) 1 молекуле 3) ½ молекулы 4) ¼ молекулы 4. Масса 9,8 г серной кислоты соответствует количеству этого вещества (в молях), равному 1) 10 2) 1 3) 0,1 4) 6∙1023 5. Оксид серы(IV) массой 96 г при н.у. займет объем (в литрах), равный 1) 22,4 2) 33,6 3) 11,2 4) 112 6. Плотность газа по воздуху равна 2. Молярная масса этого газа равна 1) 14,5 2) 58 3) 4 4) 29 7. Масса 1 л гелия при н.у. равна 0,18 г. Молярная масса гелия равна
1) 1 2) 8 3) 12 4) 10 8. 4 г водорода содержится в массе (в граммах) воды, равной 1) 18 2) 36 3) 54 4) 9 9. При одинаковых условиях в сосудах находятся равные объемы хлора и фтора. Каково соотношение масс газов 1) m(Cl2) = m(F2) 2) m(Cl2) < m(F2) 3) m(Cl2) > m(F2) 4) неопределенно 10. Каково соотношение объемов, занимаемых 1 моль водорода и 1 моль азота при одинаковых условиях (Т и Р) 1) V(N2) > V(H2) 2) V(N2) = V(H2) 3) V(N2) < V(H2) 4) неопределенно
1.6 Лабораторная работа №1 «Определение массовой доли оксида меди(II) в гидроксиде-карбонате меди(II)»
Теоретические основы: при прокаливании гидроксида-карбоната меди (II) (малахита) реакция идет по уравнению: CuCO3 · Cu(OH)2 ® 2CuO + CO2↑ + H2O↑ Вода и диоксид углерода – летучие вещества. После прокаливания остается нелетучий оксид меди(II) в виде черного порошка. Измерив массу гидроксида-карбоната меди(II) до прокаливания и массу оксида меди(II) после прокаливания, можно вычислить массовую долю СuO в соли. Цель работы: приобретение навыков правильного взвешивания на весах и выполнения стехиометрических расчетов по табличным и самостоятельно полученным данным. Оборудование и реактивы: весы лабораторные, муфельная печь, тигли фарфоровые, тигельные щипцы, ложечка для взвешивания, эксикатор, гидроксид-карбонат меди(II) CuCO3 · Cu(OH)2. Выполнение работы. Взвесьте пустой, предварительно прокаленный тигель с точностью до 0,01 г. Насыпьте в тигель 1 - 2 г гидроксида-карбоната меди и взвесьте тигель с солью с точностью до 0,01 г. Поместите Вставьте тигель с солью в керамический треугольник (рис. 1.3), поместите тигель с солью в муфельную печь и прокалите при температуре 25—3000С в течение 15-20 мин (пока зеленый порошек не превратится в черный). Охладите тигель в эксикаторе и взвесьте. Данные занесите в тетрадь по форме: Масса пустого тигля mт Масса тигля с солью mт. с. Масса соли mс Масса тигля с оксидом меди(II) (после прокаливания) m Масса оксида меди(II) m(CuO)
Сделать необходимые вычисления: а) теоретическое содержание CuO в малахите: 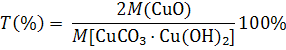
б) практическое содержание CuO в малахите:
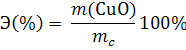 в) абсолютная ошибка: Т - Э г) относительная ошибка:
в) абсолютная ошибка: Т - Э г) относительная ошибка:
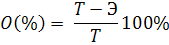
Примечание: если работа выполнена правильно и тщательно, относительная ошибка не должна превышать ± 2%. Задание к защите: Для заданного преподавателем соединения указать: 1) название; 2) молярную массу, молярную массу эквивалента; 3) степень окисления всех элементов; 4) массовую долю кислорода; 5) уравнение диссоциации; 6) графическую формулу. Варианты заданий: AlCl3, Са(ОН)2, Na3PO4, Н2CO3, CaCl2, НMnO4, KClO3, НClO4, Zn(NO3)2, Al(OН)3, AlOHCl2, Н2S, KHCO3, Cu(OH)2, Na2SO3
Тема 2. «Основные классы неорганических соединений»
Содержание программы
Многообразие химических соединений. Оксиды. Номенклатура, классификация, химические свойства и способы получения. Номенклатура, классификация, химические свойства и способы получения оснований. Кислоты. Номенклатура, классификация, химические свойства и способы получения. Соли. Номенклатура, классификация, химические свойства и способы получения. Генетическая связь классов неорганических соединений
Уровень теоретической и практической подготовки Студент должен знать классификацию неорганических соединений, в том числе и с точки зрения теории электролитической диссоциации; международную и тривиальную номенклатуру кислот, оснований и солей; химические свойства и получение веществ. Студент должен уметь определять принадлежность соединений к определенным классам, давать названия веществам; устанавливать взаимосвязи между строением вещества и его химическими свойствами. Студент должен владеть навыками составления молекулярных и структурных формул веществ.
Дата добавления: 2017-01-13; просмотров: 2530;
