Окисление металла шва флюсом
Присутствие кислорода в газовой фазе флюсовой полости обусловлено в основном тем, что:
-на поверхности металла свариваемых кромок имеются оксиды (окалина Fe3О4и ржавчинаFe2О3·2H2О), диссоциирующие
при дуговом нагреве (с выделением свободного кислорода) или
вступающие с жидким железом в реакции:
(9.43а) 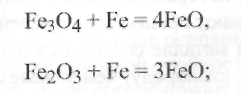 (9.436)
(9.436)
-во флюсе есть воздух и влага, диссоциирующая при сварке и
взаимодействующая с жидким железом по реакции
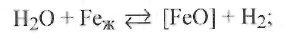 (9.44а)
(9.44а)
-при дуговой сварке происходит выделение на аноде кислорода по реакции
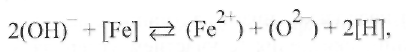 (9.446)
(9.446)
а на катоде - водорода по реакции
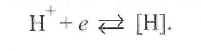 (9.45)
(9.45)
Кроме того, кислород попадает в жидкий металл ванны при прямом взаимодействии Feжс химически активными оксидами жидких шлаков в результате обменных реакций, например
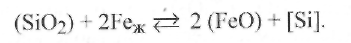 (9.46)
(9.46)
Таким образом, в шлаке возникает закись железа FeO, которая растворима в жидком железе. Если оксид, растворимый в металле, образуется во флюсе-шлаке, то между концентрациями этого оксида согласно закону распределения Нернста устанавливается определенное соотношение
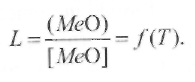 (9.47)
(9.47)
В результате реакции (9.46) жидкий металл одновременно окисляется и легируется (обычно кремнием или марганцем). Термодинамический расчет, подтверждающий ход этих реакций в указанных направлениях дан в гл. 8 (пример 8.3). Таким образом, кремнемарганцевые шлаки, имеющие большее количество кислотных оксидов (%SiO2> % МnО), окисляют капли электродного металла при высоких температурах (т. е. осуществляется первая стадия кремнемарганцевого процесса). Поэтому они считаются активными. Наряду с окислением капли кремнемарганцевые шлаки обогащают металл кремнием и марганцем, которые, попадая в более холодный металл сварочной ванны, вызывают процессы раскисления.
Если в электродном металле содержатся легирующие элементы с большим сродством к кислороду, чем у железа, то происходит их необратимое окисление при взаимодействии с SiO2и МnО. Поэтому при сварке легированных и высоколегированных сталей недопустимо применение кремнемарганцевых флюсов, которые хотя и имеют хорошие сварочно-технологические свойства, но весьма активны, так как содержат термически малопрочные оксидыSiO2и МnО, выделяющие кислород в обменных реакциях.
Ввод термически более стойких кислотных оксидов AI2O3иTiO2позволяет несколько снизить активность флюсов, но вызывает другие реакции окисления (с участием углерода и кремния) и восстановление алюминия и титана, переходящих в металл шва из флюсов. Однако окислениеAI2O3иTiO2происходит при более высоких температурах и по более сложной схеме:
· восстановление алюминия и титана из AI2O3и ТiO2кремнием;
· окисление легирующих элементов (С, Si,Mn, Сг) кислородом, выделяющимся при частичной диссоциацииAI2O3и ТiO2;
· образование в наплавленном металле остаточного кислорода (входившего в состав AI2O3и ТiO2), т. е. создаются включения.
Такой же результат имеет место при вводе кислотного оксида ZrO2. Итак, с увеличением количества кислотных термостойких оксидов в составе флюса (AI2O3,ZrO2, ТiO2) усиливаются процессы окисления легирующих элементов (Cr,Si,Mn,Nb) и восстанавливаются металлыZr,Al,Tiиз их оксидов. При этом растет общее содержание кислорода, а содержание других ферритизаторов и ферритной фазы уменьшается. Термодинамические расчеты, выполненные Н.Н. Потаповым, показали, что окисление хрома Сг и наиболее эффективного ферритизатора и стабилизатора ферритной фазы в аустените - ниобияNbпроисходит с участием диоксида кремнияSiO2, а также его монооксидаSiOпо следующим реакциям:
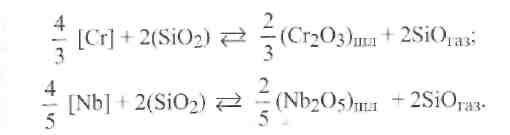 Присутствие неметаллических включений снижает сопротивляемость металла шва образованию горячих трещин, коррозионную стойкость швов и пластичность сварных соединений высоколегированных сталей.
Присутствие неметаллических включений снижает сопротивляемость металла шва образованию горячих трещин, коррозионную стойкость швов и пластичность сварных соединений высоколегированных сталей.
В отличие от кислотных оксидов основные оксиды (CaO,MgO) обладают достаточной химической стойкостью во всем диапазоне сварочных температур, но не обеспечивают необходимые технологические свойства. Из работ Б.Н. Бадьянова следует, что составы флюсов для высоколегированных сталей должны создаваться на основе компромисса, причем рекомендуется, чтобы содержание главного окислителяSiO2составляло не более 10 %, что позволит полностью связать его основными оксидами в комплексыSiO2• СаО и т. п.
Дата добавления: 2017-01-13; просмотров: 695;
