Виды раскислительных процессов
И 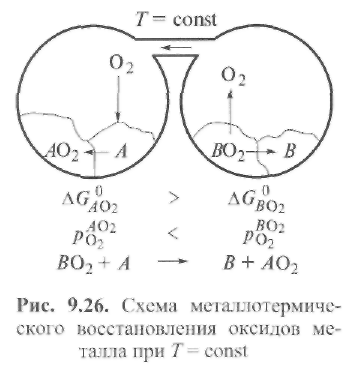 з анализа обменных реакций типа (9.52) заключаем, что по отношению к металлу такие реакции могут иметь не только окислительный, но и восстановительный характер (если равновесие реакции сдвигается влево).
з анализа обменных реакций типа (9.52) заключаем, что по отношению к металлу такие реакции могут иметь не только окислительный, но и восстановительный характер (если равновесие реакции сдвигается влево).
Поэтому для обеспечения восстановительного характера обменных реакций нужно применять элементы, которые обладают повышенным сродством к кислороду и в определенных условиях способны энергично связывать кислород, освобождая металл из оксида. На рис. 9.26 представлена схема этого процесса. В двух контейнерах находятся два различных оксида, при их нагревании выделяется кислород. Если соединить контейнеры между собой, то кислород будет перетекать в левый сосуд (с меньшим парциальным давлением). В этом сосуде находится металл А, имеющий большее химическое сродство к кислороду. Такие элементы называются раскислителями, а сам процесс восстановления металла из оксида - раскислением.
Помимо раскисления действием элементов-раскислителей существует диффузионное раскисление, при котором кислород (в составе оксида основы сплава) экстрагируется из металла с помощью сварочного шлака специального состава.
Как правило, при окислении сталей наиболее вероятно окисление основы, т. е. железа, и образование FeO, что доказано термодинамическим расчетом (см. пример 8.4). Рассмотрим процессы раскисления сталей, содержащих растворенный в них оксидFeO.
Раскисление стали с получением конденсированных продуктов реакции (осадочное раскисление)сопровождается образованием конденсированных оксидов, не растворимых в металле. К раскислителям, образующим такие оксиды, относятсяTi,Si,Mn, А1 и др. В общем виде реакция раскисления стали представляется уравнением
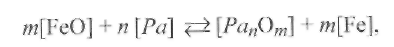 (9.53)
(9.53)
где Ра - раскислитель;т, п - стехиометрические коэффициенты. Рассчитаем константу равновесия реакции (9.53):
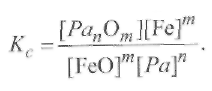 (9.54)
(9.54)
Но в сталях [Fe] ≈ 1, поэтому равновесная концентрация свободной закиси железа в металле равна
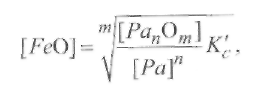 (9 55)
(9 55)
Где К'с - измененное значениеКс с учетом [Fe] ≈ 1. Следовательно, концентрация свободной закиси железа уменьшается с повышением содержания раскислителя и уменьшением концентрации оксидов данного раскислителя в металле. Если допустить, что раскислителями, как правило, служат элементы, образующие не растворимые в металле оксиды, которые удаляются в виде шлака, то концентрацию [РапОт]можно считать величиной постоянной. Тогда, исключая [РапОт] из выражения (9.55), получаем:
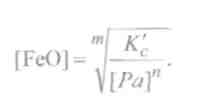
Следовательно, количество растворенного в металле оксида FeOобратно пропорционально концентрации введенного в сталь раскислителя [Ра].
Таким образом, для определенного интервала температур можно установить зависимость между концентрацией раскислителя и концентрацией находящейся с ним в равновесии свободной закиси железа. Тогда, задавая допустимое содержание [FeO], определяют соответствующую ему концентрацию раскислителя в металле. В табл. 9.2 приведены данные о тепловом эффекте важнейших обменных реакций раскисления с получением конденсированных оксидов.

Процессы, описанные реакциями в табл. 9.2, экзотермичны, т. е. сопровождаются выделением тепла. Рассмотрим характерные черты наиболее важных раскислителей этой группы, применяемых в сварочной практике.
КремнийSi(Тпл= 1713 К;Ткип = 2903 К; р = 2,37 г/см3) при окислении образует не растворимый в металле кислотный оксидSiO2, который легко создает комплексы - силикаты, в том числе и сFeO(FeO•SiO2). Силикаты железа всплывают на поверхность металла и переходят в шлак, вследствие чего раскисляющая способность кремния повышается. С повышением концентрации кремния в металле уменьшается содержание в нем закиси железа (рис. 9.27). При этом раскисляющая способность кремния заметно увеличивается с повышением температуры. Так как оксиды кремния увеличивают кислотность шлака, а вместе с тем и его вязкость, введение кремния в сварочную ванну ограничивают.
М  арганецМn(Тпл= 1517 К;Ткип= 2300 К; р = 7,46 г/см3) при окислении превращается в закись МnО - относительно сильный основный оксид, не растворимый в металле. Закись марганца образует с закисью железа непрерывный ряд растворов как в жидком, так и в твердом состоянии. Их взаимное физическое растворение приводит к уменьшению содержания в шлаке свободной закиси железа, и поэтому создаются условия для соответствующего перехода из металла в шлак новых порцийFeO. Как и для кремния, с увеличением содержания марганца в металле уменьшается концентрация в нем закиси железа (рис. 9.28). Однако влияние кремния сказывается сильнее. С увеличением температуры действие марганца как восстановителя слабеет.
арганецМn(Тпл= 1517 К;Ткип= 2300 К; р = 7,46 г/см3) при окислении превращается в закись МnО - относительно сильный основный оксид, не растворимый в металле. Закись марганца образует с закисью железа непрерывный ряд растворов как в жидком, так и в твердом состоянии. Их взаимное физическое растворение приводит к уменьшению содержания в шлаке свободной закиси железа, и поэтому создаются условия для соответствующего перехода из металла в шлак новых порцийFeO. Как и для кремния, с увеличением содержания марганца в металле уменьшается концентрация в нем закиси железа (рис. 9.28). Однако влияние кремния сказывается сильнее. С увеличением температуры действие марганца как восстановителя слабеет.
ТитанTi(Тпл= 1933 К;
Ткип= 3533 К; р = 4,54 г/см3) относится к числу сильных раскислителей, более сильных, чем кремний и марганец. Образующийся кислотный оксид ТiO2не растворим в металле, легко вступает в комплексы, переходящие в шлак. С увеличением содержания титана в стали количество закиси железа также уменьшается. Титан активно реагирует с азотом, образуя прочные нитриды, не растворимые в металле. Вместе с тем он сильный модификатор, т. е. элемент, способствующий измельчению зерна в металле.
АлюминийА1 (Тпл= 931 К;Ткип= 2773 К; р = 2,7 г/см3) является наиболее сильным раскислителем в этой группе (см. рис. 9.28). Он образует амфотерный оксидAI2O3. Раскисление жидкого металла алюминием сопровождается значительным выделением теплоты, обеспечивающим дополнительный подогрев металла сварочной ванны, что способствует более интенсивному протеканию сварочных процессов. Однако не все количество оксида алюминия всплывает на поверхность сварочной ванны, частично он остается в металле шва в виде включений. Это одна из причин ограниченного применения алюминия как раскислителя при сварке сталей. Кроме того, как и титан, алюминий склонен образовывать с азотом стойкие нитриды, снижающие пластичность швов.
Большой недостаток процесса раскисления осаждением - образование в металле неметаллических (шлаковых) включений, т. е. оксидов раскислителя. Они являются концентраторами напряжений и снижают как прочность, так и пластичность (см. рис. 9.25). Поэтому вводят одновременно два или три раскислителя, чтобы их оксиды понижали температуру плавления (см. рис. 9.19) и включения имели не игольчатую, а глобулярную форму.
Раскисление стали с получением газообразных продуктов реакцииможет быть описано двумя типичными реакциями.
1. Реакция раскисления углеродом может протекать в два этапа:
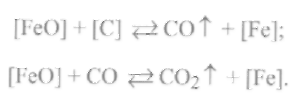 При этом наблюдается одновременное присутствие железа, закиси железа, углерода, окиси углерода и углекислого газа.
При этом наблюдается одновременное присутствие железа, закиси железа, углерода, окиси углерода и углекислого газа.
Где и при каких условиях будут протекать эти реакции? Условия равновесия между железом, оксидами железа, окисью углерода и углекислым газом .для интервала температур 673... 1273 К следуют из рис. 9.29. Штриховая линия соответствует образованию СО и СО2в присутствии твердого углерода (см. рис. 9.4). На рис. 9.29 можно отметить три характерные области.
О 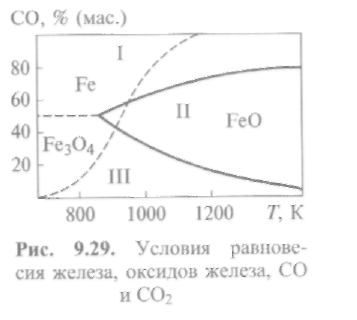 бластьI(устойчивое существование восстановленного железа) уменьшается с ростом температуры. Для этой области характерно наличие преимущественно восстановительной среды в виде СО.
бластьI(устойчивое существование восстановленного железа) уменьшается с ростом температуры. Для этой области характерно наличие преимущественно восстановительной среды в виде СО.
Область II(устойчивое существование закиси железаFeO) появляется при температурах, близких к 873 К, и увеличивается с дальнейшим ростом температуры. Для этой области характерно наличие окислительной среды, т. е. заметного количества углекислого газа.
Присутствие СО2способствует развитию процесса окисления железа по реакции
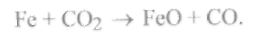 (9.59)
(9.59)
При наличии магнетита Fe3О4железо восстанавливается оксидом углерода СО до закиси железа, т. е.
 (9.60)
(9.60)
Область III(устойчивое существованиеFe3О4) уменьшается с ростом температуры(Т> 873 К). Для этой области характерна еще более сильная окислительная среда, содержащая значительное количество СО2.Окислительные процессы развиваются по реакции
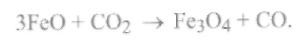 (9.61)
(9.61)
Учитывая, что сварочный процесс протекает при более высоких температурах, чем рассмотренные процессы, можно предположить следующее:
- при окислении металла устойчивой формой оксида железа будет FeO;
- раскисление металла углеродом идет только до образования СО, т. е. по реакции (9.57), так как при высоких температурах оксид углерода СО очень устойчив. Константа равновесия для первой реакции (9.57) равна
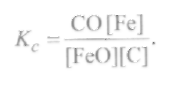
Отсюда определим равновесную концентрацию закиси железа в металле, считая, что содержание железа в стали близко к единице ([Fe] ≈1), и выражая концентрацию оксида углерода через его парциальное давлениерсо
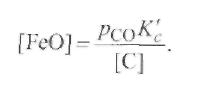 (9.63)
(9.63)
Итак, чем больше углерода в стали, тем меньше FeOобразуется при ее окислении. С ростом температуры процесса раскисляющая способность углерода повышается и раскисление идет значительно полнее, чем при низких температурах. Однако, несмотря на высокую раскисляющую способность, углерод как раскислитель находит ограниченное применение. Это объясняется следующими обстоятельствами:
· возможно образование пор в металле шва, особенно на участках, кристаллизующихся в последнюю очередь и сильно насыщенных углеродом. Естественно, что здесь наиболее бурно может протекать реакция окисления углерода и выделение СО, СО2;
· повышение содержания углерода в металле шва не всегда допустимо.
2. Реакция раскисления водородом представляется следующим уравнением:
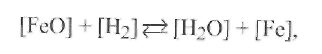
для которого константа реакции равна
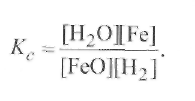
Рассуждая, как при выводе формулы (9.63), получаем
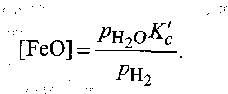 (9.64)
(9.64)
Восстановление металла водородом имеет много общего с восстановлением его окисью углерода. Однако водород раскисляет металл слабее, чем СО. При этом получаются следующие тепловые эффекты:
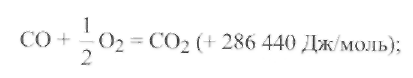
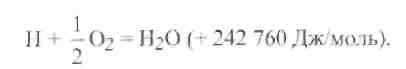
Недостатком водорода как раскислителя является его высокая растворимость в металлах, которая может привести к образованию пор и трещин.
Оценивая эффективность раскисления на основе обменных реакций, следует иметь в виду, что даже в условиях, когда процесс плавки стали протекает достаточно долго, состояние равновесия в реакциях раскисления не достигается. При сварке отклонения концентраций от равновесных будут еще большими (в сторону более высокого содержания закиси железа). Поэтому в сварочной практике часто применяют одновременно несколько раскислителей.
Для сравнения раскислительной способности некоторых элементов с углеродом на рис. 9.28 приведены кривые зависимости равновесной концентрации закиси железа от концентраций различных элементов - раскислителей при температуре 1873 К. Наибольшей раскисляющей способностью обладает А1 (затем Ti, далееSi, С и, наконец, Мnи Сг). Под раскисляющей способностью понимается концентрация кислорода в процентах по массе в сплаве, соответствующая концентрации легирующего элемента в растворе в состоянии термодинамического равновесия.
Диффузионное раскислениеосновано на частичном переходе закиси железа в шлак, так как ее распределение между этими двумя фазами подчиняется закону распределения Нернста:
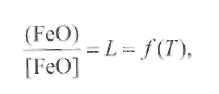 (9.65)
(9.65)
где L - константа распределения.
Для развития процесса диффузионного раскисления важно, чтобы концентрация свободной закиси железа в шлаке уменьшалась, тогда новые порции закиси железа будут переходить из металла в шлак. Это достигается различными способами:
· связыванием FeOв комплексные соединения кислотными оксидами (образованием силикатов, титанатов);
· проведением раскислительных обменных реакций;
· разбавлением шлаков нейтральными в химическом отношении добавками
Константа распределения L (рис. 9.30), определяющая степень перехода закиси железа из металла в шлак, с увеличением температуры уменьшается. Это значит, что при высоких температурах закись железа может перейти из металла в шлак в меньшем количестве, чем при низких.
П 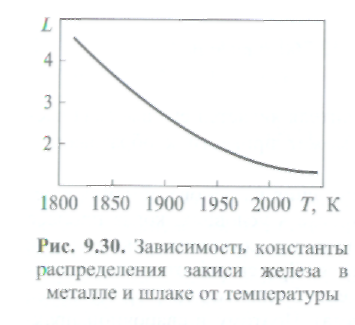 ри диффузионном раскислении закись железа удаляется из металла в шлак путем диффузии, поэтому ванна жидкого металла находится в спокойном состоянии, а все химические процессы совершаются на границе металл - шлак и в самом шлаке. Однако само раскисление протекает медленно. При температурах, близких к температуре затвердевания металла, константа распределенияL велика, но скорость диффузии в жидкой фазе минимальна и общий эффект от раскисления оказывается невысоким. Процесс диффузионного раскисления наиболее заметен при образовании капли на электроде и ее переносе, так как ему способствует достаточно высокая температура, энергичное перемешивание металла капли и непрерывный контакт свежих порций металла со шлаком. В сварочной ванне диффузионное раскисление протекает слабо и преимущественно лишь в верхнем тонком слое металла, прилегающем к шлаку.
ри диффузионном раскислении закись железа удаляется из металла в шлак путем диффузии, поэтому ванна жидкого металла находится в спокойном состоянии, а все химические процессы совершаются на границе металл - шлак и в самом шлаке. Однако само раскисление протекает медленно. При температурах, близких к температуре затвердевания металла, константа распределенияL велика, но скорость диффузии в жидкой фазе минимальна и общий эффект от раскисления оказывается невысоким. Процесс диффузионного раскисления наиболее заметен при образовании капли на электроде и ее переносе, так как ему способствует достаточно высокая температура, энергичное перемешивание металла капли и непрерывный контакт свежих порций металла со шлаком. В сварочной ванне диффузионное раскисление протекает слабо и преимущественно лишь в верхнем тонком слое металла, прилегающем к шлаку.
Вследствие отмеченных особенностей диффузионное раскисление в сварочных процессах обычно не играет большой роли.
Раскисление стали с помощью кислых и основных шлаковпротекает при контакте шлаковой и металлической фаз как на основе обменных реакций, так и путем диффузионного раскисления. Рассмотрим раскисление металла кислыми шлаками, в которых есть оксид кремния. В таких шлаках наблюдается реакция связыванияFeOв комплексы - силикаты железа, не растворимые в металле:
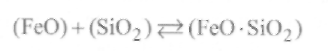 (9.66)
(9.66)
с константой равновесия реакции, равной
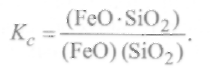 (9.67)
(9.67)
Связывание закиси FeOв силикаты вызовет дополнительный переход ее из металла в шлак. Из выражения (9.65) следует, что
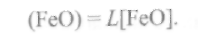 (9.68)
(9.68)
Если в уравнение (9.67) подставим (9.68), то получим
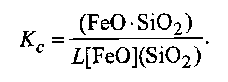 (9.69)
(9.69)
Решим уравнение (9.69) относительно [FeO]:
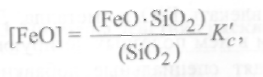 (9.70)
(9.70)
где К'с является константой, обратной произведению двух констант:L иKc.
Таким образом, при использовании кислых шлаков для уменьшения содержания закиси железа в металле шва следует увеличить содержание кислотного оксида SiO2в шлаке, т. е. повысить кислотность шлакап (см. (9.28)) и одновременно уменьшить количество образующихся в нем силикатов железа.
Однако повышение содержания SiO2в шлаке(п > 1,2) приводит к значительному ухудшению физических, а следовательно, и технологических свойств его. Шлак становится густым («длинным») его активность резко падает, нарушается и стабильность сварочного процесса. Поэтому для сохранения высокой раскисляющей способности кислых шлаков целесообразно:
1) заменить SiO2двуокисью титана ТiO2полностью или частично. Этим удается сохранить нужную степень кислотности шлака, сделать его жидкотекучим (и «коротким»), придать ему требуемую химическую активность;
2) попутно внести в такие шлаки элементы-раскислители,
дающие основные оксиды. Их роль сводится к восстановлению железа из силиката и к уменьшению в шлаке содержания силиката железа (FeO•SiO2), например:
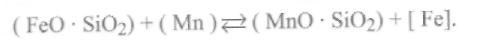
Следует отметить, что при введении в шлак этих раскислителей уменьшается его кислотность.
Рассмотрим раскисление металла основными шлаками, в которых в отличие от кислых шлаков есть избыток основных оксидов, 

 наиболее сильным из них является СаО. Такие шлаки не обладают способностью к диффузионному раскислению, так как имеющиеся в них незначительные количестваSiO2(или ТiO2) сразу же будут связываться в комплексные соединения с основными оксидами шлака, т. е.
наиболее сильным из них является СаО. Такие шлаки не обладают способностью к диффузионному раскислению, так как имеющиеся в них незначительные количестваSiO2(или ТiO2) сразу же будут связываться в комплексные соединения с основными оксидами шлака, т. е.
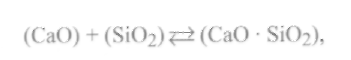 (9.72)
(9.72)
и шлак не будет извлекать FeOиз металла. Для раскисления металла с сохранением в нем полезных легирующих элементов в основные шлаки вводят специальные добавки-раскислители. Они ведут себя так же, как при осадочном раскислении металла шва, но продукты раскисления переходят в шлак.
Процесс раскисления стали шлаком можно описать уравнением реакции
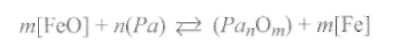
с константой равновесия, равной
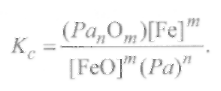 (9.73)
(9.73)
Считая, что в сталях [Fe] ≈ 1, решаем уравнение (9.73) относительно [FeO]:
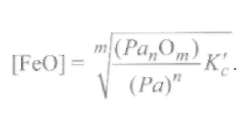 (9.74)
(9.74)
Отсюда следует, что для того чтобы снизить содержание FeOв стали, нужно увеличить в шлаке количество раскислителя(Ра) и уменьшить содержание оксида раскислителя в шлаке(РапОт).
Продукты раскисления РапОт перейдут в шлак, который в результате обогащения этими оксидами, потеряет свою раскисляющую способность. Для ее повышения или поддержания на нужном уровне нужно:
- ограничивать количество вводимого раскислителя. Чтобы повысить эффективность процесса раскисления, одновременно вносят несколько разных раскислителей;
- разбавлять шлаки специальными добавками, которые уменьшают содержание в шлаках оксида раскислителя.
В табл. 9.3 приведены в качестве примера несколько раскислителей, реакции раскисления ими металла, равновесные концентрации [FeO] и уравнения для расчета констант равновесия этих реакций.
Благодаря своим химическим свойствам основные шлаки (керамические) обеспечивают лучшее раскисление металла, чем кислые шлаки.
 Проведение раскислительных процессов хотя и снижает содержание кислорода в металле до минимума, но не восполняет целиком потерю полезных элементов вследствие их частичного выгорания и испарения. Вместе с тем раскисление не дает возможности обогатить металл специальными легирующими элементами, чтобы придать ему особые свойства. Эти задачи выполняют во время другой металлургической операции - легирования, осуществляемой одновременно с раскислением металла сварочной ванны
Проведение раскислительных процессов хотя и снижает содержание кислорода в металле до минимума, но не восполняет целиком потерю полезных элементов вследствие их частичного выгорания и испарения. Вместе с тем раскисление не дает возможности обогатить металл специальными легирующими элементами, чтобы придать ему особые свойства. Эти задачи выполняют во время другой металлургической операции - легирования, осуществляемой одновременно с раскислением металла сварочной ванны
Дата добавления: 2017-01-13; просмотров: 2261;
