Влияние кислорода на свойства стали
Кислород растворяется во многих металлах, в том числе и в железе. Изучение особенностей растворения кислорода в железе позволяет сделать выводы относительно взаимодействия кислорода со сталью, основой которой является железо. Железо с кислородом образует три оксида в результате следующих реакций:

Из этих трех оксидов только закись железа FeOрастворима в железе и поэтому наиболее сильно влияет на его свойства в составе свариваемого металла. Остальные оксиды в железе не растворяются, могут в нем присутствовать только в виде отдельных включений и легко разлагаются при высоких температурах.
Установлено, что при температуре плавления железа предельная растворимость кислорода в железе составляет сотые доли процента (0,16 %), а при комнатной температуре - тысячные доли процента. Твердый раствор О2вFeназывают оксиферритом.
На рис. 9.8 приведена левая часть диаграммы состояния «железо - кислород». При температуре 845 К закись FeO, находящаяся в железе вне твердого раствора, разлагается с образованием закиси-окиси:
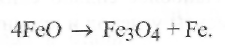 (9.16)
(9.16)
Таким образом, при комнатной температуре кислород находится в железе как в твердом растворе Fe α (в оксиферрите), так и в виде включенийFe3О4
 При сварке наблюдаются существенные отклонения от равновесной диаграммы состояния «железо - кислород». Значительный перегрев жидкого металла увеличивает растворимость кислорода более чем до 0,16 % (ветвь В-В'). В этом случае максимальная растворимость в железе определяется по уравнению
При сварке наблюдаются существенные отклонения от равновесной диаграммы состояния «железо - кислород». Значительный перегрев жидкого металла увеличивает растворимость кислорода более чем до 0,16 % (ветвь В-В'). В этом случае максимальная растворимость в железе определяется по уравнению
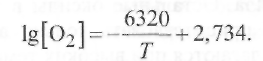 (9.17)
(9.17)
При быстром охлаждении железа может наблюдаться образование пересыщенного твердого раствора Fe α, а вне твердого раствора останется не успевшая разложиться закись железаFeO. Она войдет в состав легкоплавких ликватов, располагающихся по зонам срастания кристаллов.
Наличие легирующих элементов в стали также влияет на растворимость кислорода. Наиболее сильно снижают растворимость кислорода в железе элементы углерод и кремний, которые являются самыми активными раскислителями, связывающими О2в оксиды СО иSiО2. Ввод таких элементов в металл шва относится к физико-химическим способам его защиты.
Присутствие кислорода в сталях наряду с окислением железа вызывает непосредственное окисление ряда легирующих элементов, например:
 (9.18)
(9.18)
Очередность окисления элементов обратно пропорциональна их химическому потенциалу (вариант такого расчета приведен в гл. 8, см. пример 8.4).
Кроме того, параллельно могут идти нежелательные обменные реакции взаимодействия легирующих элементов с закисью железа, когда окислителем выступает не свободный кислород, а связанный в оксид FeO:
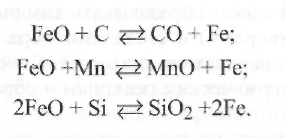 (9.19)
(9.19)
Эти реакции прогнозируют по энергии Гиббса. Возможность окисления легирующих элементов устанавливают в результате термодинамических расчетов, которые приведены в гл. 8.
Т 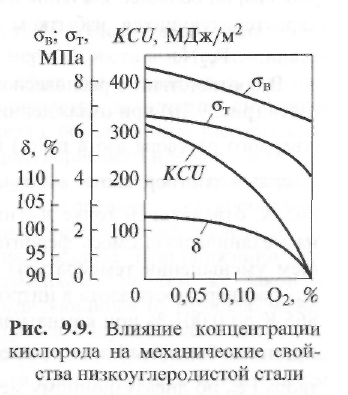 аким образом, кислород в стали присутствует главным образом в виде оксидовFeO,MnO, СаО и др., в том числе в виде комплексов сSiО2, ТiО2и другими кислыми оксидами. Как правило, оксидыFeOрасполагаются по границам зерен металла в виде стекловидных игл и поэтому играют роль микронадрезов, а комплексы - в виде легкоплавких ликватов, образующих при высоких температурах жидкие прослойки, которые после затвердевания становятся хрупкими.
аким образом, кислород в стали присутствует главным образом в виде оксидовFeO,MnO, СаО и др., в том числе в виде комплексов сSiО2, ТiО2и другими кислыми оксидами. Как правило, оксидыFeOрасполагаются по границам зерен металла в виде стекловидных игл и поэтому играют роль микронадрезов, а комплексы - в виде легкоплавких ликватов, образующих при высоких температурах жидкие прослойки, которые после затвердевания становятся хрупкими.
Наличие кислорода в стали ухудшает все свойства свариваемого металла (рис. 9.9). С Увеличением содержания кисло  рода резко уменьшаются пределы прочности σВи текучести σт, относительное удлинение δ и ударная вязкостьKCU, причем особенно значительно снижается ударная вязкость.
рода резко уменьшаются пределы прочности σВи текучести σт, относительное удлинение δ и ударная вязкостьKCU, причем особенно значительно снижается ударная вязкость.
Наряду с этим при увеличении содержания кислорода в стали происходит следующее: уменьшается стойкость против коррозии; обнаруживается склонность к старению; при содержании кислорода более 0,08 % появляется склонность к хладно- и красноломкости; усиливается рост зерен при нагреве; ухудшается способность к обработке резанием и ковке; понижается магнитная проницаемость и увеличивается электрическое сопротивление.
9.2.2. Влияние азотанасвойства стали
Атомарный азот растворяется преимущественно в тех металлах, с которыми он может образовывать химические соединения -нитриды. При растворении в стали азот образует нитриды как с железом, так и с большинством примесей. С железом азот взаимодействует по эндотермическим реакциям и образует два типа нитридов:
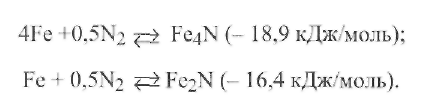 Нитрид Fe4Nсодержит 5,88 % N2, а нитридFe2N- 11,1 % N2.
Нитрид Fe4Nсодержит 5,88 % N2, а нитридFe2N- 11,1 % N2.
Для сварки большее значение имеет нитрид Fe4N, а для процессов, характеризующихся избытком азота, например для азотизации стали,-Fe2N.
В соответствии с равновесной диаграммой состояния «железо -азот» (рис. 9.10) при охлаждении сплава вначале из нитроаустенита
(твердого раствора азота в Feγ) выпадаетα-фаза, или нитроферрит (твердый раствор азота вFeα). После достижения температуры 865 К, отвечающей точкеА1, нитроферрит-эвтектоид распадается на механическую смесь феррита и нитрида железа. При дальнейшем уменьшении температуры в равновесных условиях предельная растворимость азота в нитроферрите снижается от 0,135 % при 865 К до 0,001 % при комнатной температуре. Это приводит к тому, что избыточный азот в видеFe4Nвыделяется из твердого раствораFeαпо диффузионному механизму.
В 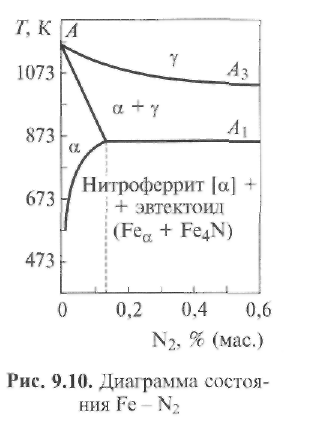 неравновесных условиях сварки этот процесс практически не развивается, и получают сталь, пересыщенную азотом. При последующем нагреве или при вылеживании происходит медленное выделение нитридов железа. Это явление называют старением. Оно снижает пластичность стали. При нагревании выше 900 К сталей, содержащих нитриды железа, они диссоциируют.
неравновесных условиях сварки этот процесс практически не развивается, и получают сталь, пересыщенную азотом. При последующем нагреве или при вылеживании происходит медленное выделение нитридов железа. Это явление называют старением. Оно снижает пластичность стали. При нагревании выше 900 К сталей, содержащих нитриды железа, они диссоциируют.
Таким образом, в железе азот может находиться в твердом растворе Feαи в виде отдельных включений нитридов - главным образомFe4N. В результате сварки и здесь имеют место существенные отклонения от равновесной диаграммы состоянияFe- N2. Поэтому общее количество растворенного в металле азота вследствие перегрева металла может быть увеличенным. Кроме того, при повышенной скорости охлаждения металла может не закончиться процесс выпадения нитридов железа из твердого раствораFeα, который останется пересыщенным азотом.
С легирующими элементами стали азот также образует нитриды, часто значительно более стойкие, чем нитриды железа. Особенно стойкими в области высоких температур являются нитриды кремния и титана.
Равновесная растворимость азота в железе сильно зависит от температуры (см. рис. 9.6, б). По мере ее роста в интервале существования феррита растворимость азота увеличивается, а в интервале существования аустенита снижается вследствие снижения парциального давления азота в связи с образованием твердых нитридов по аналогии со снижением растворимости водорода в титане (см. рис. 9.7). В этом интервале кривые зависимости равновесной растворимости от температуры претерпевают скачкообразные изменения в моменты полиморфных превращений железа и при переходе его из твердого состояния в жидкое. При снижении температуры растворимость азота изменяется по тем же законам. В период кристаллизации азот, выделяющийся из металла, может вызвать порообразование. Несмотря на малую степень диссоциации азота в зоне столба дуги (см. рис. 8.9, а), а также ионизации (см. рис. 8.9, б), азот в металле шва присутствует в значительном количестве, что объясняется большим содержанием его в атмосфере и спецификой его поведения в зоне сварки.
Исследования процесса насыщения металла азотом показали, что возможны следующие пути его протекания.
1. Диссоциированный азот непосредственно растворяется в
жидком металле капель. При последующем охлаждении металла
образуются нитриды железа. Роль этого процесса мала, так как
степень диссоциации при сварке незначительна.
2. Диссоциированный азот образует в высокотемпературной
области дугового разряда (см. рис. 9.1) окись азота NО, которая
растворяется в каплях. При температурах металла ниже 3300 К
окись азота диссоциирует на поверхности сварочной ванны, при
этом атомарный азот, вступая во взаимодействие с железом, обра-
зует нитриды железа, а кислород - оксиды железа. Термодинами-
ческим расчетом и экспериментом (см. рис. 9.5) подтверждено, что
последний вариант (с участием кислорода) наиболее вероятен.
3. Диссоциированный азот непосредственно образует с диссо-
циированным кислородом в области высоких температур стойкие
нитриды, которые, растворяясь согласно закону Сивертса в жидком
металле капли, насыщают его азотом. В этом случае по мере охла
ждения металла сварочной ванны из раствора может выделиться
атомарный азот, который, вступая во взаимодействие с железом,
образует нитриды железа.
Содержащиеся в стали нитриды азота весьма сильно влияют на ее свойства. Из рис. 9.11 следует, что с увеличением содержания 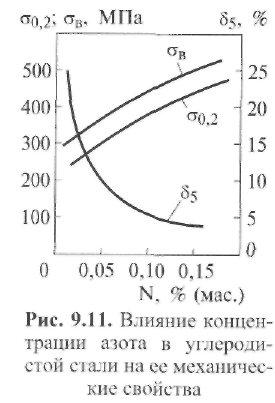 азота N в металле повышаются пределы прочности (σВ) и текучести (σТ). Этим влияние азота на свойства стали принципиально отличается от влияния кислорода. Вместе с тем по аналогии с кислородом снижаются пластические свойства и особенно резко — ударная вязкость стали. Наряду с этим происходят и другие нежелательные изменения: появляется склонность металла к старению и к хладноломкости (синеломкости); увеличивается склонность к закалке; понижается магнитная проницаемость; увеличивается электрическое сопротивление металла.
азота N в металле повышаются пределы прочности (σВ) и текучести (σТ). Этим влияние азота на свойства стали принципиально отличается от влияния кислорода. Вместе с тем по аналогии с кислородом снижаются пластические свойства и особенно резко — ударная вязкость стали. Наряду с этим происходят и другие нежелательные изменения: появляется склонность металла к старению и к хладноломкости (синеломкости); увеличивается склонность к закалке; понижается магнитная проницаемость; увеличивается электрическое сопротивление металла.
Итак, для углеродистых и низколегированных сталей азот -нежелательная примесь в металле шва, особенно при действии на него динамической нагрузки. При сварке легированных сталей осуществляют микролегирование азотом с целью частичной замены углерода и увеличения пластичности и прочности сталей. Азот, как и углерод, образует твердый раствор внедрения, т. е. является сильным упрочнителем, но в отличие от углерода не образует карбидов, которые при нагреве растворяются в стали. Нитриды железа более термостойки, чем Fe3C.
При сварке деталей из высоколегированных сталей аустенитного класса азот вводится специально, так как он повышает устойчивость аустенита и выступает как легирующая добавка, способная заменить некоторое количество углерода и никеля. В таких сталях азот устраняет явление транскристаллизации и улучшает механические свойства, а также может вызвать и эффект упрочнения чугуна.
В условиях сварки деталей из меди азот применяют в качестве инертного защитного газа, не взаимодействующего с медью.
Дата добавления: 2017-01-13; просмотров: 8383;
