НАРУШЕНИЯ ТЕЧЕНИЯ И СОСТОЯНИЯ КРОВИ
Стаз
• Стаз (от лат. stasis — остановка) — резкое замедление и остановка тока крови в сосудах микроциркуляторного русла, главным образом в капиллярах.
Причиной развития стаза являются нарушения циркуляции крови, возникающие при действии физических (высокая и низкая температура) и химических (токсины) факторов, при инфекционных, инфекционно-аллергических и аутоиммунных заболеваниях, болезнях сердца и сосудов.
Механизм развития.В возникновении стаза большое значение имеют изменения реологических свойств крови, обусловленные развитием сладж-феномена (от англ. sludge — тина), для которого характерно прилипание друг к другу эритроцитов, лейкоцитов или тромбоцитов и нарастание вязкости плазмы, что приводит к затруднению перфузии крови через сосуды микроциркуляторного русла. Развитию внутрикапиллярной агрегации эритроцитов способствуют следующие факторы:
▲ изменения капилляров, ведущие к повышению их проницаемости и плазморрагии;
▲ нарушение физико-химических свойств эритроцитов;
▲ изменение вязкости крови за счет грубодисперсных фракций
белков;
▲ нарушения циркуляции крови — венозное полнокровие (застойный стаз);
▲ ишемия (ишемический стаз) и др.
Стаз — явление обратимое. Длительный стаз ведет к необратимым гипоксическим изменениям — некробиозу и некрозу.
Тромбоз
• Тромбоз (от греч. thrombosis — свертывание) — прижизненное свертывание крови в просвете сосуда или полостях сердца. Образующийся при этом сверток крови называют тромбом.
Хотя тромбоз представляет собой один из важнейших механизмов гемостаза, он может стать причиной нарушения кровоснабжения органов и тканей с развитием инфарктов, гангрены.
Патогенез.Патогенез тромбоза складывается из участия как местных, так и общих факторов.
К местным факторам относят изменения сосудистой стенки, замедление и нарушение тока крови.
Среди изменений сосудистой стенки особенно важно повреждение внутренней оболочки сосуда, чаще всего обусловленное атеросклеретическими и воспалительными поражениями ее. К повреждению стенки сосуда ведут и ангионевротические расстройства — спазмы артерий и артериол. Повреждение эндокарда при эндокардитах, инфарктах миокарда также сопровождается тромбообразованием.
Замедление и нарушение (завихрение) тока крови в артериях обычно возникают вблизи атеросклеротических бляшек, в полости аневризмы, при спазме; в венах — при варикозном расширении. Роль нарушений тока крови в развитии тромбоза подтверждается наиболее частой их локализацией на месте ветвления сосудов. О значении замедления тока крови для тромбообразования свидетельствует частое возникновение тромбов в венах при развитии сердечно-сосудистой недостаточности, при сдавлении вен опухолями, беременной маткой, иммобилизации конечности.
К общим факторам патогенеза тромбоза относят нарушение регуляции свертывающей и противосвертывающей систем крови и изменение состава крови. Главная роль принадлежит нарушениям баланса между свертывающей и противосвертывающей системами в регуляции жидкого состояния крови в сосудистом русле. Состояния повышенной свертываемости (гиперкоагуляция) часто являются следствием обширных хирургических операций и травм, беременности и родов, некоторых лейкозов, сопровождающихся тромбоцитозом (истинной полицитемин и других миелопролиферативных заболеваний), спленэктомии, эндотоксемии, шока, реакций гиперчувствительности, злокачественных опухолей.
Среди изменений состава (качества) крови наибольшее значение имеет повышение вязкости. Оно может быть обусловленс эритроцитозом или полицитемией, возникающими при дегидратации (чаще у детей), при хронических гипоксических состояниях (дыхательной недостаточности, цианотических врожденных пороках сердца), истинной полицитемии, увеличении содержания грубодисперсных фракций белков (например, при миеломной болезни).
С практической точки зрения важно выделить группы больных со склонностью к образованию тромбов. К ним можно отнести:
▲ больных, находящихся на длительном постельном режиме после операции;
▲ страдающих хронической сердечно-сосудистой недостаточностью (хроническим венозным полнокровием);
▲ больных с атеросклерозом;
▲ онкологических больных;
▲ беременных;
▲ больных с врожденными или приобретенными состояниями гиперкоагуляции, предрасполагающими к рецидивирующему тромбозу.
Механизм образования тромба.Инициальным моментом тромбообразования является повреждение эндотелия. Тромб образуется при взаимодействии тромбоцитов (кровяных пластинок), поврежденного эндотелия и системы свертывания крови (коагуляционного каскада).
Тромбоциты. Основная их функция — поддержание целости сосудистой стенки — направлена на прекращение или предотвращение кровотечения и является важнейшим звеном гемостаза. Тромбоциты осуществляют следующие функции:
▲ участвуют в репарации эндотелия посредством выработки PDGF (тромбоцитарный фактор роста);
▲ формируют тромбоцитарную бляшку на месте повреждения сосуда в течение нескольких минут — первичный гемостаз;
▲ участвуют в коагуляционном каскаде (вторичный гемостаз) путем активации фактора 3 тромбоцитов, что в конечном счете приводит к тромбообразованию.
Эндотелий. Для сохранения крови в своем обычном состоянии необходима целостность (структурная и функциональная) сосудистого эндотелия. Интактная эндотелиальная клетка модулирует некоторые звенья гемостаза и обеспечивает тромборезистентность, т.е. противостоит тромбообразованию в результате следующих процессов:
▲ продукция гепарансульфата — протеогликана, активирующего антитромбин III, который нейтрализует тромбин и другие факторы свертывания, включая IXa, Xa, XIa и ХПа;
▲ секреция естественных антикоагулянтов, таких как тканевый активатор плазминогена;
▲ расщепление АДФ;
▲ инактивация и резорбция тромбина;
▲ синтез тромбомодулина — поверхностноклеточного протеина, связывающего тромбин и превращающего его в активатор протеина С — витамин К-зависимый плазменный протеин, который ингибирует коагуляцию, лизируя факторы Va и VI—Иа;
▲ синтез протеина S — кофактора активированного протеина С;
▲ продукция PGI-2 — простациклина, обладающего антитромбогенным эффектом;
▲ синтез оксида азота (II) (NO), который действует аналогично PGI-2.
Понимание этих антитромбогенных механизмов, осуществляемых эндотелиальной клеткой на ее поверхности, позволяет понять значение дисфункции эндотелия как триггера тромбообразования.
Существуют также следующие факты, доказывающие про-тромбогенную функцию эндотелия:
• эндотелий синтезирует фактор Виллебранда, который способствует агрегации тромбоцитов и фактора V;
• эндотелий способен связывать факторы IX и X, что может вызвать коагуляцию на поверхности эндотелия;
• под воздействием интерлейкина-1 и фактора некроза опухоли (ФНО) эндотелий выбрасывает в плазму тромбопластин — потенциальный инициатор свертывания крови по внешней системе (внешнему пути).
Активация системы свертывания крови. Это решающий этап в прогрессировании и стабилизации тромба. Процесс завершается образованием фибрина — вторичный гемостаз. Это многоэтапный каскадный ферментативный процесс — коагуляционный каскад, требующий довольно много времени; при этом последовательно активируются проферменты. В процессе свертывания прокоагулянты — тромбопластины, превращаются в активные ферменты — тромбины, способствующие образованию из циркулирующего в крови растворимого фибриногена нерастворимого фибрина. Образующиеся нити фибрина скрепляют агрегаты тромбоцитов, образовавшиеся при первичном гемостазе. Это имеет большое значение для предотвращения вторичного кровотечения из крупных сосудов, наступающего через несколько часов или дней после травмы.
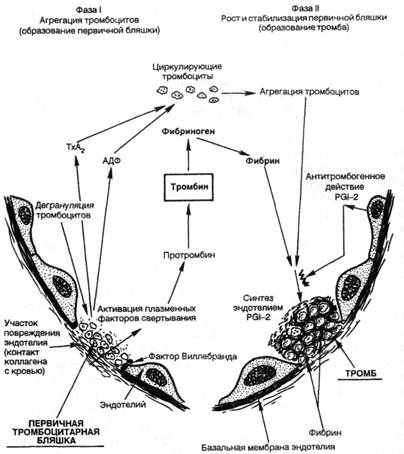
Механизм тромбообразования (тромбогенез) представлен следующими звеньями (рис. 4).
1. Адгезия тромбоцитов к обнаженному коллагену в месте повреждения эндотелиальной выстилки осуществляется с помощью фибронектина на поверхности тромбоцитов и стимулируется в большей степени коллагеном типа III, чем коллагеном базальной мембраны (IV тип). Медиатором является фактор Виллебранда, вырабатываемый эндотелием.
2. Секреция тромбоцитами АДФ и тромбоксана-А2 (ТХ-А2). вызывающего вазоконстрикцию и агрегацию тромбоцитов (блокирование образования Тх-А2 небольшими дозами аспирина лежит в основе превентивной терапии тромбообразования), гистамина, серотонина, PDGF и др.
3. Агрегация тромбоцитов — образование первичной тромбоцитарной бляшки.
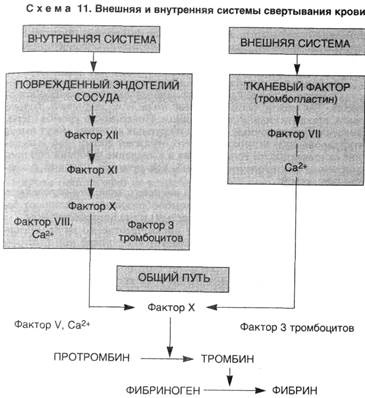
4. Активация процесса свертывания крови, или коагуляционного каскада (схема 11), с помощью следующих механизмов:
▲ внутренней системы свертывания, которая запускается контактной активацией фактора XII (Хагемана) коллагеном, фактора XI, прекалликреина, высокомолекулярного кининогена и усиливается фосфолипидом тромбоцитов (фактор 3), высвобождающимся при конформационных изменениях их мембраны;
▲ внешней системы свертывания, которая запускается тканевым тромбопластином, высвобождающимся из поврежденного эндотелия (тканей), и активирует фактор VII. В конечном итоге оба пути приводят к превращению протромбина (фактор II) в тромбин (фактор Па), который способствует превращению фибриногена в фибрин, а также вызывает дальнейшее выделение АДФ и Тх-А2 из тромбоцитов, способствуя их агрегации.
5. Агрегация стабилизируется образующимися отложениями фибрина — стабилизация первичной бляшки. В дальнейшем фибриновый сверток захватывает лейкоциты, агглютинирующиеся эритроциты и преципитирующие белки плазмы крови.
Таким образом, можно выделить следующие стадии морфогенеза тромба: ▲агглютинация тромбоцитов; ▲ коагуяция фибриногена с образованием фибрина; ▲ агглютинация эритроцитов; ▲ преципитация плазменных белков.
Рис. 4. Механизм образования тромба (схема). Объяснение в тексте.
Система свертывания работает в тесной связи с фибринолитической системой, которая модулирует коагуляцию и препятствует тромбообразованию. Механизм Действия фибринолитической истемы складывается из следующих стадий:
▲ превращение проэнзима плазминогена в плазмин — наиболее важный фибринолитический фермент; ▲ растворение фибрина с помощью плазмина; ▲ взаимодействие фибринолитической системы с системой свертывания на уровне активации фактора XII в ХIIа связывает систему свертывания, систему комплемента и кининовую систему.
Морфология тромба.Тромб обычно прикреплен к стенке сосуда в месте ее повреждения, где начался процесс тромбообразования. Он может быть пристеночным (т.е. закрывать только часть просвета) или обтурирующим. Поверхность тромба шероховатая. Пристеночные тромбы в крупных артериях могут иметь гофрированную поверхность, что отражает ритмичное выпадение склеивающихся тромбоцитов и выпадение фибрина при продолжающемся кровотоке. Тромб, как правило, плотной консистенции, сухой.
В зависимости от строения и внешнего вида, что определяется особенностями и темпами тромбообразования, различают белый, красный, смешанный (слоистый) и гиалиновый тромбы.
Белый тромб состоит преимущественно из тромбоцитов, фибрина и лейкоцитов, образуется медленно при быстром токе крови (чаще в артериях). Красный тромб, помимо тромбоцитов и фибрина, содержит большое число эритроцитов, образуется быстро при медленном токе крови (обычно в венах). В наиболее часто встречающемся смешанном тромбе, который имеет слоистое строение (слоистый тромб) и пестрый вид, содержатся элементы как белого, так и красного тромба. В смешанном тромбе различают головку (имеет строение белого тромба), тело (собственно смешанный тромб) и хвост (имеет строение красного тромба). Головка прикреплена к эндотелиальной выстилке сосуда, что отличает тромб от посмертного сгустка крови. Слоистые тромбы чаще образуются в венах, в полости аневризмы аорты и сердца. Гиалиновый тромб — особый вид тромбов, образующихся в сосудах микроциркуляторного русла; он редко содержит фибрин, состоит из разрушенных эритроцитов, тромбоцитов и преципитирующих белков плазмы, напоминающих гиалин. Увеличение тромба происходит путем наслоения тромботических масс на первичный тромб, причем рост тромба может происходить как по току крови, так и против тока. Исход тромбоза.Может быть различен. К благоприятным исходам относят асептический аутолиз тромба, возникающий под влиянием протеолитических ферментов и прежде всего плазмина. Установлено, что большинство мелких тромбов рассасывается в самом начале их образования. Другим благоприятным исходом является организация тромба, т.е. замещение его соединительной тканью, которая может сопровождаться процессами канализации и васкуляризации (восстановление проходимости сосуда). Возможно обызвествление тромба, в венах при этом возникают камни — флеболиты.
К неблагоприятным исходам относят отрыв тромба с развитием тромбоэмболии и септическое расплавле ние тромба, которое возникает при попадании в тромботические массы гноеродных бактерий, что приводит к тромбобактериальной эмболии сосудов различных органов и тканей (при сепсисе).
Значение тромбоза.Определяется быстротой его развития локализацией и распространенностью. Обтурирующие тромбы в артериях — явление опасное, так как приводят к развитию ин фарктов и гангрены.
Эмболия
• Эмболия (от греч. emballon — бросать внутрь) — циркуляцю в крови (или лимфе) не встречающихся в нормальных условия? частиц и закупорка ими сосудов. Сами частицы называются эмболами.
Эмболы чаще перемещаются по току крови — ортоградная эмболия:
а из венозной системы большого круга кровообращения и правого сердца в сосуды малого круга;
▲ из левой половины сердца и аорты и крупных артерий в более мелкие артерии (сердца, почек, селезенки, кишки и др.). В редких случаях эмбол в силу своей тяжести движется против тока крови — ретроградная эмболия. При наличии дефектов в межпредсердной или межжелудочковой перегородке возникав! парадоксальная эмболия, при которой эмбол из вен большого круга, минуя легкие, попадает в артерии большого круга кровообращения. В зависимости от природы эмболов различают тромбоэмболию, жировую, воздушную, газовую, тканевую (клеточную), микробную эмболию и эмболию инородными телами.
Тромбоэмболия— наиболее частый вид эмболии, возникает при отрыве тромба или его части.
Тромбоэмболия легочной артерии. Это одна из наиболее частых причин внезапной смерти у больных в послеоперационном периоде и больных с сердечной недостаточностью. Источником тромбоэмболии легочной артерии при этом обычно являются возникающие при венозном застое тромбы вен нижних конечностей, вен клетчатки малого таза. В генезе смерти при тромбоэмболии легочной артерии придается значение не столько механическому фактору закрытия просвета сосуда, сколько пульмонокоронарному рефлексу. При этом наблюдается спазм бронхов, ветвей легочной артерии и венечных артерий сердца. При тромбоэмболии мелких ветвей легочной артерии обычно развивается геморрагический инфаркт легкого.
Артериальная тромбоэмболия. Источником артериальной эмболии чаще являются пристеночные тромбы, образующиеся в сердце: тромбы в левом предсердии при стенозе левого атриовентрикулярного отверстия (митральный стеноз) и фибрилляции; тромбы в левом желудочке при инфаркте миокарда; тромбы на створках левого предсердно-желудочкового (митрального) и аортального клапанов при ревматических, септических и других эндокардитах, пристеночные тромбы, возникающие в аорте в случае атеросклероза. При этом наиболее часто возникают тромбоэмболия ветвей сонной артерии, средней мозговой артерии (что приводит к инфаркту мозга), ветвей мезентериальных артерий с развитием гангрены кишки и ветвей почечной артерии с развитием инфаркта почки. Часто развивается тромбоэмболический синдром с инфарктами во многих органах.
Жировая эмболияразвивается при попадании в кровоток капель жира. Обычно это происходит в случае травматического повреждения костного мозга (при переломе длинных трубчатых костей), подкожной жировой клетчатки. Изредка жировая эмболия возникает при ошибочном внутривенном введении масляных растворов лекарственных или контрастных веществ. Попадающие в вены жировые капли обтурируют капилляры легких или же, минуя легкие, через артериовенозные анастомозы поступают в капилляры почек, головного мозга и других органов. Жировые эмболы обнаруживаются обычно только при микроскопическом исследовании срезов, специально окрашенных для выявления жиров (суданом III). Жировая эмболия приводит к острой легочной недостаточности и остановке сердца, если выключается 2/3 легочных капилляров. Жировая эмболия капилляров мозга вызывает появление многочисленных точечных кровоизлияний в мозговой ткани; при этом возможен смертельный исход.
Воздушная эмболияразвивается при попадании в кровоток воздуха, что изредка встречается при ранении вен шеи (этому способствует отрицательное давление в них), после родов или аборта, при повреждении склерозированного легкого, случайном введении воздуха вместе с лекарственным веществом. Попавшие в кровь пузырьки воздуха вызывают эмболию капилляров малого круга кровообращения, наступает внезапная смерть. На вскрытии воздушная эмболия распознается по выделению воздуха из правых отделов сердца при проколе их, если предварительно заполнить полость перикарда водой. Кровь в полостях сердца имеет пенистый вид.
Газовая эмболияхарактерна для кессонной болезни, развивается при быстрой декомпрессии (т.е. быстром переходе от повышенного к нормальному атмосферному давлению). Высвобождающиеся при этом пузырьки азота (находящегося при вы-
соком давлении в растворенном состоянии) вызывают закупорку капилляров головного и спинного мозга, печени, почек и других органов. Это сопровождается появлением в них мелких фокусов ишемии и некроза (особенно часто в ткани мозга). Характерным симптомом являются миалгии. Особая склонность к развитию кессонной болезни отмечается у тучных людей, поскольку большая часть азота задерживается жировой клетчаткой.
Тканевая эмболиявозможна при разрушении тканей в связи с травмой или патологическим процессом, ведущим к поступлению кусочков тканей (клеток) в кровь. К тканевой относят также эмболию амниотической жидкостью у родильниц. Такая эмболия может сопровождаться развитием синдрома диссеминированного внутрисосудистого свертывания и привести к смерти. Особую категорию тканевой эмболии составляет эмболия клетками злокачественной опухоли, так как она лежит в основе метастазирования опухолей.
Микробная эмболиявозникает в тех случаях, когда циркулирующие в крови микробы обтурируют просвет капилляров. Это могут быть также грибы, паразиты, простейшие. Часто бактериальные эмболы образуются при гнойном расплавлении тромба — тромбобактериальная эмболия. На месте закупорки сосуда бактериальными эмболами образуются метастатические гнойники.
Эмболия инородными теламинаблюдается при попадании в кровь осколков металлических предметов (снарядов, пуль и пр.). К эмболии инородными телами относят также эмболию известью и кристаллами холестерина атеросклеротических бляшек, выкрашивающихся в просвет сосуда при их изъязвлении.
Значение эмболии.Для клиники значение эмболии определяется видом эмбола. Наибольшее значение имеют тромбоэмболические осложнения и прежде всего тромбоэмболия легочной артерии, ведущая к внезапной смерти. Велико также значение тромбоэмболического синдрома, сопровождающегося множественными инфарктами и гангреной. Не меньшее значение имеет бактериальная и тромбобактериальная эмболия — одно из ярких проявлений сепсиса, а также эмболия клетками злокачественных опухолей как основа их метастазирования.
Многие из видов нарушений кровообращения патогенетически тесно связаны и находятся в причинно-следственных отношениях, например связь кровотечения, плазморрагии и отека с полнокровием, связь малокровия с эмболией и тромбозом, а последнего — со стазом и венозным полнокровием. Расстройства кровообращения лежат в основе многих клинических синдромов, таких как острая и хроническая сердечная (сердечно-сосудистая)
недостаточность, диссеминированное внутрисосудистое свертывание крови (ДВС-синдром), тромбоэмболический синдром, шок.
Шок
• Шок — циркуляторный коллапс, сопровождающийся гипоперфузией тканей и снижением их оксигенации.
Причины шока.Различают следующие причины шока: а снижение сердечного выброса, что обычно бывает при кровопотерях или тяжелой (левожелудочковой) сердечной недостаточности;
▲ распространенная периферическая вазодилатация, что наблюдается чаще при сепсисе или тяжелой травме, сопровождающейся гипотензией.
Типы шока и их патогенетические особенности.Различают гиповолемический, кардиогенный, септический и сосудистый типы шока.
Гиповолемический шок, в основе которого лежит циркуляторный коллапс, обусловлен острым уменьшением объема циркулирующей крови. Наблюдается при следующих состояниях:
▲ тяжелой кровопотере;
▲ массивной потере плазмы поврежденной кожей (при обширных ожогах или травме, аллергических повреждениях кожи);
▲ потере жидкости и электролитов желудочно-кишечным трактом при тяжелой рвоте и диарее.
Кардиогенный шок возникает вследствие снижения сердечного выброса при быстром падении сократительной функции миокарда (при обширном инфаркте миокарда и других состояниях, приводящих к острой сердечной недостаточное га).
Септический (токсико-инфекционный) шок может быть эндотоксическим (вызывается липополисахаридами, наиболее часто возникает при инфекциях, вызванных грамотрицательной микрофлорой) и экзотоксическим (при инфекциях, вызванных грамположительной микрофлорой, например экзотоксином Staphylococcus aureus).
Выделяют следующие звенья патогенеза септического шока: а эндотоксин и другие бактериальные продукты индуцируют освобождение производных арахидоновой кислоты и цитокинов (таких, как интерлейкин-1 и ФНО) в больших концентрациях;
▲ стимулируется NO-синтетаза в эндотелии и гладких мышечных клетках сосудистой стенки, что сопровождается синтезом оксида азота (II) — N0, вызывающего стойкие вазодилатацию и гипотензию;
▲активируется система комплемента с освобождением анафилатоксинов С3а/С5а; ▲ активация нейтрофилов приводит к повреждению эндотелия и резкому повышению проницаемости капилляров; ▲ активация фактора XII запускает процесс свертывания, что приводит к развитию ДВС-синдрома.
Сосудистый шок может быть анафилактическим и нейрогенным, который чаще всего связан с тяжелой травмой (травматический шок). Пусковым механизмом нейрогенного шока является афферентная (преимущественно) болевая импульсация, что приводит к реактивной периферической вазодилатации.
Развитие сосудистого шока связано с "секвестрацией крови" (в крупных периферических сосудах благодаря потере вазомоторного тонуса и в капиллярах вследствие постоянной венулярной констрикции), увеличением сосудистой проницаемости, с замедлением кровотока вследствие развития сладж-феномена.
Стадии шока.Различают три стадии.
1. Непрогрессирующая (ранняя) стадия. Характерны компенсаторные механизмы, включающие избирательную артериальную вазоконстрикцию, увеличивающую периферическую резистентность и компенсирующую снижение сердечного выброса для поддержания перфузии жизненно важных органов. Вазоконстрикция преимущественно развивается в сосудах кожи и кишечника, в то время как в сердце, головном мозге и мышцах циркуляция поддерживается на обычном уровне. Когда механизмы вазоконстрикции оказываются недостаточными для поддержания нормального кровяного давления, развивается развернутая клиническая картина шока.
2. Прогрессирующая стадия. Характеризуется тканевой гипоперфузией и началом развития циркуляторных и метаболических нарушений, включающих метаболический ацидоз, связанный с лактатацидемией. Сосуды перестают отвечать на нормальные констрикторные стимулы. Развивается прогрессирующая артериолярная дилатация и кровь "секвестрируется" в резко расширенном капиллярном русле. Развивается глубокий коллапс.
3. Необратимая стадия. Развиваются повреждения органов и метаболические расстройства, не совместимые с жизнью.
Морфологические проявления шока.Во внутренних органах развивается гипоксическое повреждение в виде дистрофии и некроза. Характерны быстрая мобилизация гликогена из тканевых Депо, а также нарушения гемокоагуляции в виде ДВС-синдрома, геморрагического диатеза, жидкой трупной крови, которые мо-гут явиться основой для диагностики шока на вскрытии. Микроскопически выявляются микротромбы в системе микроциркуляции, сочетающиеся с признаками повышенной проницаемости капилляров, геморрагиями.
Морфологические изменения при шоке могут иметь ряд особенностей, обусловленных как структурно-функциональной специализацией органа, так и преобладанием в патогенезе шока одного из его звеньев — нейрорефлекторного, токсического, гипоксического. Руководствуясь этим положением, при характеристике шока стали использовать термин "шоковый орган".
Одним из наиболее важных "шоковых" органов является шоковая почка,в которой развивается некротический нефроз (при наличии ДВС-синдрома возможно развитие симметричных кортикальных некрозов), что обусловливает острую почечную недостаточность.
Для шоковой печенихарактерно развитие центролобулярных некрозов с возможным развитием острой печеночной недостаточности. При сочетании острой почечной и печеночной недостаточности говорят о гепаторенальном синдроме.
В шоковом легкомразвиваются очаги ателектаза, серозно-геморрагический отек с выпадением фибрина в просвет альвеол (гиалиновые мембраны), стаз и тромбы в микроциркуляторном русле, что обусловливает развитие острой дыхательной недостаточности — респираторного дистресс-синдрома взрослых.
Структурные изменения миокардапри шоке представлены жировой дистрофией, контрактурами миофибрилл, некробиотическими изменениями кардиомиоцитов с развитием мелких фокусов некроза.
Выраженные изменения при шоке выявляются и в других органах: в желудочно-кишечном трактеопределяются кровоизлияния, в головном мозге— фокусы некроза, мелкие кровоизлияния, в надпочечниках— истощение коркового вещества (исчезновение липидов).
Во время шокового состояния недостаточность различных органов возникает в определенной последовательности. Почки, кишечник и легкие поражаются в первую очередь. Печень длительное время сохраняет функциональную активность, однако и в ней развиваются изменения, связанные с гипоксией. Поражения нервной системы, эндокринных желез и сердца встречаются редко. Порядок поражения внутренних органов может быть иной, что обычно связано или с особенностями этиологического фактора, или с наличием предсуществующих заболеваний того или иного органа, что делает соответствующий орган особенно чувствительным.
Лекция 10
Дата добавления: 2016-12-26; просмотров: 972;
