Реакции нейтрализации и гидролиз солей
К обменным реакциям в растворах относят взаимодействие между кислотами и основаниями, в результате которых образуется соль и вода. Такие реакции называются реакциями нейтрализации и доходят до конца только тогда, когда единственным малодиссоциированным веществом в системе является вода, например: НС1 + КОН = КС1 + Н2О. Сокращенное ионное уравнение этого процесса Н++ОН–=Н2О. Оно показывает, что равновесие полностью смещено в сторону образования воды. Взаимная нейтрализация кислот и оснований, отличающихся друг от друга по силе, до конца не протекает. Так, при взаимодействии слабой уксусной кислоты с гидроксидом калия в системе из четырех веществ два слабодиссоциированы: СНзСООН + КОН ↔ Н2О + СНзСООК, или в сокращенном ионном виде СНзСООН + ОН– ↔ Н2О + СНзСОО–. Эта реакция обратима. Обратная реакция - взаимодействие соли и воды - называется реакцией гидролиза. Гидролизу подвергаются соли, образованные:
1) Слабым основанием и сильной кислотой;
2) сильным основанием и слабой кислотой;
3) слабыми основанием и кислотой.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Приведем примеры реакций гидролиза.
Гидролиз соли, образованной сильным основанием и слабой кислотой - ацетата натрия. Соль в растворе полностью диссоциирует: СНзСООNa ↔ СНзСОО– + H+.
Гидролиз в ионной форме: СН3СОО-+Н2О↔СН3СООН+ОН-.
В результате гидролиза реакция среды стала основной (избыток ОН-), рН>7. Показателем глубины протекания гидролиза является степень гидролиза β:
β=Сгидр/С,
где Сгидр – концентрация гидролизованных молекул, С – исходная концентрация растворенных молекул соли. Гидролиз – процесс эндотермический, поэтому, в соответствии с принципом Ле-Шателье, с повышением температуры степень гидролиза увеличивается.
Принимая, что в разбавленных растворах активность ионов мало отличается от их концентрации (С=а), можно записать константу равновесия 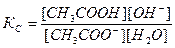 . Так как концентрация воды при гидролизе изменяется мало, принимаем ее постоянной, и, Кс[Н2О]=КГ, получаем константу гидролиза:
. Так как концентрация воды при гидролизе изменяется мало, принимаем ее постоянной, и, Кс[Н2О]=КГ, получаем константу гидролиза: 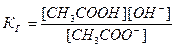 . Подставляя вместо [ОН-]=Kw/[H+], получаем:
. Подставляя вместо [ОН-]=Kw/[H+], получаем: 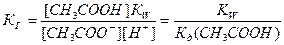 .
.
Отсюда следует, что гидролиз идет тем глубже, чем ниже константа диссоциации слабого электролита, образующегося при гидролизе.
Гидролиз солей, образованных сильной кислотой и слабым основанием, например, хлорида аммония:
NH4Cl↔NH4+ + Cl- (диссоциация соли)
NH4+ + H2O ↔ NH4OH + H+, среда кислая, рН<7.
Степень гидролиза и константа гидролиза для данной реакции описываются аналогично приведенным для реакции гидролиза соли, образованной слабой кислотой и сильным основанием.
Гидролиз соли, образованной слабой кислотой и слабым основанием, протекает как по катиону, так и по аниону. Константа гидролиза зависит от констант диссоциации слабых кислоты НА и основания ВОН: 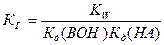 . В зависимости от силы кислоты и основания реакция среды может быть как щелочной, так и кислой.
. В зависимости от силы кислоты и основания реакция среды может быть как щелочной, так и кислой.
Итак, гидролиз изменяет реакцию среды (подкисляет или подщелачивает). Степень гидролиза возрастает с разбавлением раствора и при увеличении температуры.
Дата добавления: 2016-05-11; просмотров: 1125;
