Водородный показатель.
Вода служит не только наиболее распространенным растворителем, но и сама является идеальным амфолитом. Процесс диссоциации воды называется самоионизацией или автопротолизом, и может быть записан: Н2О+Н2О↔Н3О++ОН–. Часто этот процесс записывают в более простом виде: Н2О↔Н++ОН–. Константа диссоциации этого процесса 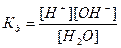 , более строго через активности ионов:
, более строго через активности ионов: 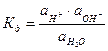 .
.
Так как вода - слабый электролит, можно использовать данные выражения с учетом того, что концентрация воды постоянна: [Н2О]=55,56 моль/л. Тогда [Н+][ОН-]=55,56 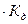 =КW=10-14 – ионное произведение воды. Так как при диссоциации воды [Н+]=[ОН-]=
=КW=10-14 – ионное произведение воды. Так как при диссоциации воды [Н+]=[ОН-]= 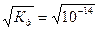 =10-7 моль/л.
=10-7 моль/л.
Ионы водорода являются носителями кислотных свойств, гидроксил-анионы - щелочных. Поэтому при равенстве этих ионов раствор будет нейтральным. Для характеристики кислотности (щелочности) среды введен водородный показатель рН=-lg[Н+]. При рН=7 среда нейтральная, для кислых растворов рН меньше 7, для щелочных рН больше 7.
Аналогичным образом реакция среды может быть охарактеризована гидроксильным показателем рОН=-lg[ОН–]. Для воды рН=рОН=7, рН+рОН=14.
Дата добавления: 2016-05-11; просмотров: 652;
