Константа диссоциации
Процесс электролитической диссоциации удобнее характеризовать константой диссоциации, применив к нему законы химического равновесия. Так, для реакции КА↔К++А– константа диссоциации 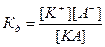 . Здесь и далее в квадратных скобках обозначаются молярные концентрации компонентов. Чем больше
. Здесь и далее в квадратных скобках обозначаются молярные концентрации компонентов. Чем больше
величина 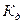 , тем сильнее электролит. Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температуры, и не зависит от концентрации раствора. Между константой и степенью диссоциации существует количественная зависимость. Пусть в рассмотренном выше процессе диссоциации общее количество растворенного вещества КА равно С, а степень диссоциации ά. Тогда [К+]=[А-]= άС, и, соответственно, концентрация недиссоциированных частиц [КА]= (1- ά)С. Подставив это значение в выражение для константы диссоциации, получим:
, тем сильнее электролит. Константа диссоциации зависит от природы диссоциирующего вещества и растворителя, а также от температуры, и не зависит от концентрации раствора. Между константой и степенью диссоциации существует количественная зависимость. Пусть в рассмотренном выше процессе диссоциации общее количество растворенного вещества КА равно С, а степень диссоциации ά. Тогда [К+]=[А-]= άС, и, соответственно, концентрация недиссоциированных частиц [КА]= (1- ά)С. Подставив это значение в выражение для константы диссоциации, получим:
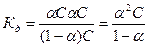 .
.
Это соотношение называется законом разбавления Оствальда. Для слабых электролитов, когда ά много меньше 1, 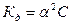 . Отсюда
. Отсюда
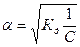 , где V=1/С - разбавление.
, где V=1/С - разбавление.
Из уравнения Оствальда следует, что ά уменьшается с увеличением концентрации слабого электролита. Например, при разбавлении раствора в 1 00 раз степень диссоциации возрастает в 10 раз.
В растворах слабых электролитов взаимодействие ионов друг с другом относительно невелико, вследствие их незначительной концентрации. Сильные электролиты в растворах диссоциированы практически полностью, поэтому концентрация их ионов велика и свойства таких растворов зависят от степени взаимодействия образующихся ионов друг с другом и с полярными молекулами растворителя. За счет этого взаимодействия создается впечатление, что диссоциация прошла и в растворе имеется некоторое количество недиссоциированных молекул. Поэтому ά, определяемая в растворах сильных электролитов экспериментально, является кажущейся и ее значение менее 100%. Поэтому для растворов сильных электролитов не применимы законы идеальных растворов. Чтобы эти законы использовать для описания реальных растворов, Льюис ввел представление об эффективной концентрации - активности а: а=γС, где С - концентрация, γ - коэффициент активности (величина безразмерная). Активность и концентрация измеряются в одних и тех же единицах. Коэффициент активности характеризует степень отклонения свойств данного раствора от свойств идеального. Для бесконечно разбавленных растворов электролитов, где практически отсутствует взаимодействие ионов, а=С и γ=1. Если вместо С в уравнения Вант-Гоффа, Рауля, Оствальда подставлять экспериментальные значения а, то уравнения остаются справедливыми и для сильных электролитов, и вообще для любых реальных растворов.
Дата добавления: 2016-05-11; просмотров: 798;
