Законы распределения электронов в электронных оболочках
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральное государственное образовательное Учреждение высшего образования
Московский государственный университет технологий и управления имени
К.Г. Разумовского (Первый казачий университет)»
Донской казачий государственный институт пищевых технологий и экономики
(филиал) ФГБОУ ВО «МГУТУ имени К.Г.Разумовского (ПКУ)»
Н.П. ВАССЕЛЬ
Неорганическая химия
Конспект лекций
Ростов - на - Дону
Печатается по решению кафедры химии и биологии ДКГИПТиЭ (филиала) МГУТУ в г. Ростове-на-Дону
Протокол № 8 от 22.04.2016г
Вассель Н.П.
Неорганическая химия. Конспект лекций. Ростов н/Д: электронная версия, 2016.- 30с.
Конспект лекций предназначается для студентов бакалавриата
направлений подготовки 19.03.02 «Продукты питания из растительного сырья» и 19.03.04 «Технология продукции и организация общественного питания». 38.03.07.
Атом – это электронно-ядерная система, состоящая из одного ядра и движущихся в его поле электронов.
Ядро атома заряжено положительно, носителем положительного заряда ядра является протон.
В ядра атомов всех элементов, за исключением легкого изотопа водорода, входят протоны и нейтроны.
Нейтрон – нейтральная элементарная частица. Масса протона приблизительно равна массе нейтрона (mp = 1,673· 10–27 кг, mn = 1,675 · 10–27 кг).
Электрон – отрицательно заряженная элементарная частица.
Масса электрона mе = 9,109 · 10–31 кг. Масса электрона почти в 1840 раз меньше массы протона и нейтрона. Поэтому масса атома практически равна массе ядра – сумме масс нуклонов – протонов и нейтронов.
Массовое число А равно общему числу протонов (Z) и нейтронов (N), входящих в состав ядра:
А = Z + N Атомы с одинаковым числом протонов (Z) называются изотопами:
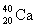 (20p, 20n),
(20p, 20n), 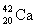 (20p, 22n),
(20p, 22n), 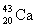 (20p, 23n).
(20p, 23n).
Большинство химических элементов имеет изотопы. Если изотопный состав элемента известен, то его атомную массу можно найти как среднюю величину масс атомов всех изотопов с учетом распространенности изотопов. Так, природный хлор состоит из двух изотопов- 35Cl и 37Cl, массы которых равны, соответственно 34,964 и 36,961, относительные распространенности составляют 75,53 и 24,47%. Атомная масса элемента хлора равна (34,964Х75,53 + 36,961Х24,47):100=35,453. Поэтому все химические элементы имеют нецелочисленное значение атомной массы.
В основе современного учения о строении атома лежат представления квантовой механики о двойственной корпускулярно-волновойприроде микрочастиц.
Электрон (как и любая микрочастица) наряду со свойствами вещества (частицы) обладает волновыми свойствами (дифракцией, интерференцией).
Частота пребывания электрона, т. е. плотность электронного облака, в той или иной части атомного объема неодинакова.
Околоядерное пространство, в котором с наибольшей вероятностью пребывает электрон, называется атомной орбиталью (АО).
Основная характеристика, определяющая состояние электрона в поле ядра атома, – это его энергия, принимающая не любые, а лишь определенные дискретные (прерывистые), квантующиеся значения.
АО характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml) Занимая ту или иную АО, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму. Форма электронных облаков аналогична АО. Их также называют электронными или атомными орбиталями.
Электронное облако характеризуется четырьмя квантовыми числами (n, l, ml , ms). Эти квантовые числа связаны с физическими свойствами электрона.
n – главное квантовое число, характеризует энергию энергетического уровня (размер электронного облака). Принимает положительные целочисленные значения от 1 до бесконечно больших чисел. Для электронов, находящихся в небозбужденных атомах, n изменяется от 1 до 7(соответствует номеру периода в периодической системе элементов).
l – орбитальное квантовое число (побочное, азимутальное), характеризует орбитальный момент количества движения электрона (энергетический подуровень); определяет форму электронного облака. Принимает все целочисленные значения от 0 до ( n - 1)
ml – магнитное квантовое число, связано с магнитным моментом электрона и указывает на ориентацию электронного облака относительно избранного направления или относительно направления магнитного поля. Может принимать все целочисленные значения от - l до + l ,включая и 0.
ms – спиновое квантовое число, характеризует внутреннее движение электрона – спин. Спин электрона возникает за счет вращения его вокруг собственной оси, принимая значения +1/2 и -1/2.
Законы распределения электронов в электронных оболочках
Распределение электронов в атомах элементов по АО определяется тремя положениями: принципом Паули, принципом наименьшей энергии и правилом Хунда.
| Принцип Паули: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел, или два любых электрона в атоме должны отличаться по крайней мере значениями одного квантового числа. |
Следствия из принципа Паули:
1. На одной АО могут находиться не более двух электронов, причем с противоположно направленными спинами (  ) ms=+1/2 и ms=-1/2.
) ms=+1/2 и ms=-1/2.
2. Максимальное число электронов на данном подуровне (емкость) на s-подуровне – 2 электрона ; на р-подуровне – 6 электронов на d-подуровне – 10 электронов на f-подуровне – 14
3. Число орбиталей данного энергетического уровня равно n2, поэтому емкость энергетического уровня составляет 2n2. То есть емкость уровней по мере удаления от ядра увеличивается и составляет:
на 1-м энергетическом уровне – 2 электрона;
на 2-м энергетическом уровне – 8 электронов;
на 3-м энергетическом уровне – 18 электронов;
на 4-м энергетическом уровне – 32 электрона.
Дата добавления: 2016-12-16; просмотров: 849;
