Стабилизирующие белковую молекулу и определяющие ее конформацию.
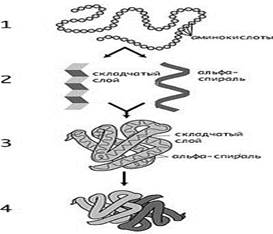
ВТОРИЧНУЮ структуру - белковая цепь закручена в спираль под действием водородных связей; ТРЕТИЧНУЮструктуру - спираль сворачивается в клубок под действием гидрофобных-гидрофильных взаимодействий (процесс происходит в водном растворе), возникающих дисульфидных связей боковых радикалов между собой (возникают глобулярная структура) белка, а само образование получило название глобулы); ЧЕТВЕРТИЧНАЯструктура белка - возникает при взаимодействии нескольких глобул (например, молекула гемоглобина). Вторичная, третичная и четвертичная структуры белка зависят от первичной. Чем крупнее белковая молекула, чем выше ее организация, тем слабее связи (химические), тем легче разрушается молекула белка. Но если не разрушена первичная структура белка, то есть возможность восстановления структуры белка. Савокупность всех структур называют конформацией белка.
7. Современные представления о классификации белков. Их биологические функции.По растворимости: водорастворимые, солерстворимые, спирторастворимые, нерастворимые и пр. По конформационной структуре: фибриллярные, глобулярные.
По химическому строению: протеины – состоят только из аминокислот, протеиды – помимо АК имеют в составе небелковую часть (углеводы, липиды, металлы, нуклеиновые кислоты) функции. КАТАЛИТИЧЕСКАЯ, или ферментативная; эта функция уникальна, так как многие процессы в клетке носят ферментативный характер. Эта функция несвойственна другим биополимерам. ТРАНСПОРТНАЯ - гемоглобин - транспорт кислорода. ЗАЩИТНАЯ - образование антител, свертывание белка крови при образовании фибрина. СОКРАТИТЕЛЬНАЯ- сократительные белки в мышечной ткани. СТРУКТУРНАЯ- белки обязательные компоненты всех клеточных мембран. ГОРМОНАЛЬНАЯ - наряду с нервной системой гормоны-белки управляют работой различных органов и организма в целом.ЭНЕРГЕТИЧЕСКАЯ - белки наряду с липидами и углеводами являются источниками энергии в клетке.
8. Физико-химические свойства белков: молекулярная масса, растворимость в воде, изоэлектрическая точка, диализ, денатурация. Характерными физическими свойствами белков являютсявысокая вязкость растворов, ограниченная способность к диффузии, способностьк значительному набуханию, оптическая активность, подвижность в электрическом поле. Белкиобладают большой гидрофильностью, чем обусловлено высокое онкотическое давление белков. Растворы белков имеют низкое осмотическое давление. Белки являются высокомолекулярными соединениями. Это полимеры, состоящие из сотен и тысяч аминокислотных остатков - мономеров. Соответственно молекулярная масса белков находится в пределах 10 000 - 1 000 000. гемоглобин -молекулярная масса 64 500 (574 аминокислотных остатка).Денатурация белков— нарушение общего плана строения белковой молекулы, приводящее к потере характерных для нее свойств под влиянием различных физических и химических факторов. Внешне денатурация проявляется потерей растворимости, повышением вязкости, резким снижением биологической активности белка. Ренатурация белка(обратный процесс с полным восстановлением структуры и функции молекулы белка) возможна при непродолжительном действииденатурирующеего агента. Изоэлектрическая и изоионная точки белковЗначение pH раствора, при котором суммарный заряд белковых молекул равен нулю, — это изоэлектрическая точка белка (pI). Она определяется аминокислотным составом белка. Изоионный раствор белка — раствор, содержащий только ионизированные остатки аминокислот и ионы, образующиеся при диссоциации воды. Изоионной точкой белка называется значение pH изоионного раствора этого белка.а 4аРастворимость белковв воде зависит от свойств белков: формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ(некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде.) С другой стороны, увеличение концентрации нейтральных солей может способствовать вьшадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков.
9. 9.Физико-химические свойства белков. Использование этих свойств при получении фармпрепаратов белковой природы.Склонность большинства белков к денатурации в процессе их выделения, хранения и использования серьёзно затрудняет их получение и применение в медицине. Для правильного обращения с белковыми лекарственными препаратами к ним прикладывают инструкцию, в которой указывают условия их хранения и использования. Так, большинство белковых препаратов необходимо хранить в холодильнике при температуре не выше 10 °С, растворять сухие препараты охлаждённой до комнатной температуры кипячёной водой во избежание их денатурации. В медицине денатурирующие агенты часто используют для стерилизации медицинских инструментов и материала, а также в качестве антисептиков.
10. Сложные белки. Глюко- и нуклеопротеины - структура и биологические функции.Простые белки построены только из аминокислот. Сложные белки построены из двух компонентов - простой белок и небелковое вещество, называемое простетической группой. Простетические группы прочно связаны с белковой частью молекулы. Гликопротеины (содержат углеводы). Нуклеопротеины (содержат
нуклеиновые кислоты).Гликопротеин- представитель группы сложных соединений, в состав которых входит белок и углевод (например,галактоза или манноза). Примерами гликопротеинов являются некоторые ферменты, гормоны и антигены.
Нуклеопротеин- присутствующее в клетках соединение, в состав которого входят нуклеиновая кислота и белок. Рибосомы представляют собой нуклеопротеины, в состав которых входит РНК; хромосомы представляют собой нуклеопротеины, в состав которых входит ДНК, гистоновые и негистоновые белки. Молекулярная масса нуклеиновых кислот сильно варьирует, но в целом очень большая, особенно у ДНК. В ядре клетки человеческого организма содержится 46 молекул ДНК, в составе каждой из них - 3,5 млрд пар мононуклеотидов. Общее количество белков, закодированных в человеческой ДНК, не превышает 100 тыс.
11. 11.Сложные белки. Липо- и фосфопротеины. Структура и функции на примере липопротеинов плазмы крови и казеина молока. Все липиды , за исключением свободных жирных кислот , попадают в плазму в форме макромолекулярных комплексов, называемых липопротеидами. Липопротеин- представитель группы сложных белков, присутствующих в лимфе и плазме крови, которые представляют собой соединения белков с липидами Липопротеин - это сферические частицы, состоящие из гидрофобной сердцевины и гидрофильной оболочки. Сердцевина содержит неполярные липиды - триглицериды и эфиры холестерина . Оболочка построена из полярных липидов - холестерина и фосфолипидов , причем заряженные концы этих молекул обращены наружу. Кроме того, в состав оболочки входят белки, нековалентно связанные с фосфолипидами и холестерином, - апопротеины. Апопротеины поддерживают структуру липопротеидных частиц и обеспечивают их взаимодействие с рецепторами липопротеидов . Циркулируя в крови, липопротеидные частицы обмениваются между собой поверхностными липидами и апопротеинами. Апопротеины служат "визитной карточкой" липопротеидов, поскольку рецепторы липопротеидов на разных клетках распознают только определенные апопротеины. В плазме крови человеканаходится несколько фракций липопротеинов, различающихся по плотности:1) хиломикроны; 2) пре-β-ЛП (липопротеины очень низкой плотности –ЛПОНП); 3) β-ЛП (липопротеины низкой плотности – ЛПНП); 4) α-ЛП (липопротеины высокой плотности – ЛПВП). липопротеины участвуют в структурной организации миелиновых оболочек нервной ткани, хлоропластов, фоторецепторной и электронно-транспортных систем, палочек и колбочек сетчатки глаза. Фосфопротеины содержат в своем составе в значительных количествах
фосфорную кислоту, соединенную с белком сложноэфирной связью с окси-группой серина или треонина. Представителями фосфопротеинов являются белок молока казеин; вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца; овальбумин, открытый в белке куриного яйца; ихтулин, содержащийся в икре рыб и др. Большое количество фосфопротеинов содержится в клетках центральной нервной системы.
12. Хромопротеины. Структура, функциональное сходство и различие молекул гемоглобина и миоглобина. Мутантные гемоглобины человека.Хромопротеины — собирательное название сложных белков с окрашенными простетическими группами различной химической природы. К ним относятся множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции — гемопротеины (белки содержащие в качестве простетической группы гем хлорофиллы; флавопротеиды с флавиновой группой, и др. Два белка – гемоглобин и миоглобин – часто называют дыхательными ферментами Оба этих вещества выполняют роль переносчиков придыхании: гемоглобин – основной компонент красных кровяных телец (эритроцитов), переносящих по артериям кислород из легких к тканям;миоглобин – красный белок в мышцах, принимающий кислород от гемоглобина и хранящий его там до того момента, когда он потребуется для окисления пищевых веществ. Эти процессы в организме сопряжены с одновременным переносом углекислого газа, переправляемого из тканей в легкие, в основном в виде бикарбоната. Перенос бикарбоната и углекислого газа идет также при содействии гемоглобина. Миоглобин и гемоглобин представляют собой белки, соединенные с железосодержащим пигментом – гемом3 миоглобин и гемоглобин обладают уникальной способностью обратимо связывать O2 без окисления гемового Fe2+ в Fe3+.
13. 13.Кинетика оксигенизирования гемоглобина. Конформационные изменения в молекуле. Транспорт Н+ и СО2. Гемоглобин связывает четыре молекулы кислорода на тетрамер (по одной на гем в каждой субъединице); к нему присоединяется не белковая часть железа, а к железу присоедин. молекула кислорода. Связывание кислорода сопровождается разрывом солевых связей, образованных концевыми карбоксильными группами субъединиц Это облегчает связывание следующих молекул кислорода, поскольку при этом требуется разрыв меньшего числа солевых связей. Указанные изменения заметно влияют на вторичную, третичную и особенно четвертичную структуру гемоглобина. Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт углекислого газа от тканей к легким. Гемоглобин связывает углекислый газ сразу после высвобождения кислорода; Находящаяся в эритроцитах карбоангидраза катализирует превращение поступающего из тканей углекислого газа в угольную кислоту Угольная кислота быстро диссоциирует на бикарбонат-ион и протон,. Для предотвращения опасного повышения кислотности крови должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода 0и определяет буферную емкость крови В легких идет обратный процесс: присоединение кислорода к
дезоксигемоглобину сопровождается высвобождением протонов 0, которые связываются с бикарбонат-ионами, переводя их в угольную кислоту. Далее эффективно действующая карбоангидраза катализирует превращение угольной кислоты в углекислый газ, выдыхаемый из легких. Таким образом, связывание кислорода тесно сопряжено с выдыханием углекислого газа. Это обратимое явление известно как эффект Бора . Эффект Бора является свойством тетрамерного гемоглобина и определяется гем-гемовым взаимодействием, лежащим в основе кооперативных эффектов.
14. 14. Химическая природа и функции ферментов. Биомедицинское значение, использование в фармации. Единицы измерения ферментативной активности.По химической природе ферменты делятся на две группы -однокомпонентные ( состоящие только из белка, их активность обусловлена активным центром - специфической группы аминокислот в белковой молекуле (пепсин, трипсин )) и двухкомпонентные ( состоящие из белка ( апофермента -носителя белка ) и белкового компонента ( коферментом ), причём химическая природа коферментов бывает разной, так как они могут состоять из органических ( многие витамины, НАД, НАДФ ) или неорганических ( атомы металлов : железа, магния, цинка )). Функции ферментов сводятся к ускорению химических реакций, причем ферменты отличаются от других катализаторов тремя уникальными свойствами: высокой эффективностью действия; специфичностью действия; способностью к регуляции; Ферменты проявляют свою активность не только в организме, но и вне его. Это открывает огромные возможности применения ферментов в фармацевтической промышленности, в медицине, В медицинской практике используются ферменты для перфузии (очищения) крови в специальных колонках типа «искусственная почка» и «искусственная печень».Изучением роли ферментов в развитии заболеваний занимается энзимопатология. Энзимодиагностика изучает роль ферментов в диагностике заболеваний. И третье направление медицинской энзимологии – энзимотерапия включает в себя использование ферментов в качестве лекарственных препаратов.
15. Международная классификация ферментов и номенклатура. Примеры.Название фермента формируется из следующих частей: 1. название субстрата с которым он взаимодействует 2. характер катализируемой реакции 3. наименование класса ферментов (но это необязательно) 4. суффикс -аза- пируват - декарбоксил - аза, сукцинат - дегидроген – аза Поскольку уже известно порядка 3 тыс. ферментов их необходимо классифицировать. В настоящее время принята международная классификация ферментов, в основу которой положен тип катализируемой реакции. Выделяют 6 классов, которые в свою очередь делятся на ряд подклассов 1.Оксидоредуктазы. окислительно-восстановительные реакции. Делятся на 17 подклассов. Все ферменты содержат небелковую часть в виде гема или производных витаминов В2ФАД, В5.HSCoA Субстрат, подвергающийся окислению выступает как донор водорода. (лактатдегидрогеназа) 2.Трансферазы - переносит функциональныетгруппы от одно в-ва к другому Аминотрансферазы (АлАТ) - перенос аминогрупп коферментом являнтся В6 : пируват + глутамат = аланин + альфа-кетоглутарат 3.Гидролазы - реакции гидролиза, т.е. расщепление веществ с присоединением по месту разрыва связи воды. К этому классу относятся преимущественно пищеварительные ферменты, они однокомпонентные (не содержат небелковой части) липаза.4. Лиазы - реакции расщепления молекул без присоединения воды. Эти ферменты имеют небелковую часть в виде В1и В6. Лиазы связи С-С. декарбоксилазы. С-О.гидратазы-дегидратазы енолаза. С-N. С-S. 5.Изомеразы – внутримолекулярный перенос функциональных групп одного атома углерода к другому
5. Лигазы реакции синтеза более сложных веществ из простых. Такие реакции идут с затратой энергии АТФ. К названию таких ферментов прибавляют "синтетаза".
16. Понятия: фермент, субстрат, фермент-субстратный комплекс, активный и аллостерический центр.Фермент биологические катализаторы белковой природы, способные ускорять биохимические реакции. Вещество, превращение которого катализирует фермент, получило название с у б с т р а т (Общее уравнение биохимической реакции, катализируемой ферментом, можно записать в следующем виде: E + S ⇌ ES → EP ⇌ E + P, где Е — фермент, S — субстрат, ES, EP — комплекс фермента и субстрата, фермента и продукта реакции, соответственно, P — продукт реакции) Участок молекулы фермента, где происходит связывание и превращение субстрата, называют активным центром. Активный центр фермента функционально неоднороден. Контактный участок обеспечивает присоединение субстрата, каталитический – принимает непосредственное участие в химическом катализе. Кроме активного центра уферментов есть аллостерический, или регуляторный центр, посредством которого осуществляется регуляция активности данного фермента. К нему могут присоединяться гормоны и их производные, различные метаболиты, медиаторы и др. Их называют либо активаторами, либо ингибиторами, в зависимости от того, повышают или понижают они скорость ферментативной реакции. Механизм действия ферментного катализа можно условно разделить на три стадии. Первая стадия – связывание фермента с субстратом, т.е. образование первичного фермент-субстратного комплекса. Вторая стадия – превращение первичного комплекса в один или несколько активированных промежуточных комплексов и образование продукта реакции. Третья стадия отщепление от активного центра конечных продуктов ферментативной реакции.
17. 17.Факторы, влияющие на активность ферментов. Концентрация субстрата. Уравнение Михаэлиса-Ментон. Константа Михаэлиса. Вещество, превращение которого катализирует фермент, получило название с у б с т р а тПри низких концентрациях субстрата скорость реакции пропорциональна концентрации субстрата и по отношению к нему - это реакция первого порядка. С увеличением концентрации субстрата приращение скорости с каждым разом уменьшается и, наконец, она становится практически независимой от концентрации субстрата. В этих условиях реакция по отношению к субстрату - нулевого порядка, а весь фермент полностью насыщен субстратом и не может функционировать быстрее. Скорость ферментативной реакции при полном насыщении фермента субстратом называется м а к с и м а л ь н о й с к о р о с т ь ю.
Vmax · [S ]
V =
Кm + [S ]
Это окончательное уравнение, выведенное для односубстратной реакции, называют у р а в н е н и е м М и х а э л и с а - М е н т е н. Данное уравнение позволяет легко измерять максимальную скорость из экспериментальных данных, полученных при любой фиксированной концентрации фермента. График зависимости скорости ферментативной реакции от концентрации субстрата представляет собой гиперболу скорости реакции катализируемой ферментом, от 1/2 Vmax концентрации субстрата При высокой концентрации субстрата и при постоянстве других факторов скорость ферментативной реакции зависит от концентрации фермента.
66. Понятие о первых и вторых посредниках. Ионы кальция как вторые посредники. Каскад ионов Са2+. ПЕРВЫЕ ПОСРЕДНИКИ.Химические агенты, обеспечивающие межклеточное общение, называются первыми посредниками. Они принадлежат к одной 'из трех групп: 1) локальные химические медиаторы, которые действуют на клетки, непосредственно окружающие источник сигналов; 2) гормоны, секретируемые специализированными эндокринными клетками и распространяющиеся по кровеносным сосудам; они взаимодействуют с клетками-мишенями, распределенными по всему телу; 3) нейротрансмиттеры, секретируемые нервными клетками; они являются близкодействующими химическими медиаторами, адресованными только соседней клетке-мишени. Стероидные гормоны проходят через плазматическую мембрану и активируют белки цитоплазмы. Другие первые посредники-- нейротрансмиттеры и некоторые гормоны -- не проникают в клетку. Однако существует процесс эндоцитоза, при котором некоторые крупные молекулы могут проходить в клетку при помощи рецепторов. Эти последние в большинстве случаев возвращаются в плазматическую мембрану и снова функционируют.ВТОРЫЕ ПОСРЕДНИКИ.Факторы роста, гормоны, нейротрансмиттеры связываются на поверхности клеток-мишеней со специализированными рецепторными белками, которые при этом изменяют свою кон-формацию. В результате этого изменения генерируется внутриклеточный молекулярный так называемый второй посредник - новая или освобождающаяся молекула. Основными вторыми посредниками являются сАМР и ион кальция. Кальций. Простейший внутриклеточный посредник - это ион кальция (Ca) . Его свободная концентрация в покоящейся клетке очень низка и составляет 108-107 моль/л. Он может проникать в клетку через специфические мембранные каналы, когда они находятся в открытом состоянии, например при изменениях мембранного потенциала. Возникающее в результате повышение концентрации кальция (Ca) запускает важные реакции в клетке, такие, как сокращение миофибрилл, которое является основой мышечного сокращения, или выделение везикул, содержащих медиаторы, из нервных окончаний.Ca оказывающий регуляторное действие, может высвобождаться также и из внутриклеточных депо, таких, как эндоплазматический ретикулум.
Дата добавления: 2016-12-08; просмотров: 2827;
