Классификация электродов
Электроды первого рода. Металлическая пластинка, погруженная в раствор соли того же металла. При обратимой работе элемента, в который включен электрод, на металлической пластинке идет процесс перехода катионов из металла в раствор либо из раствора в металл.
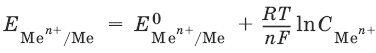
Электроды второго рода. Металл покрыт малорастворимой солью этого металла и находится в растворе, содержащем другую растворимую соль с тем же анионом. Электроды этого типа обратимы относительно аниона.
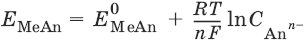
Электроды сравнения – электроды с точно известными и воспроизводимыми значениями потенциалов.
Водородный электрод представляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Адсорбируемый платиной водород находится в равновесии с газообразным водородом.
Pt, Н2 / Н+
Электрохимическое равновесие на электроде:
2Н+ + 2е¯ ↔ Н2.
Потенциал стандартного водородного электрода (с активностью ионов Н+ 1 моль/л и давлением водорода 101,3 кПа) принят равным нулю.
Электродный потенциал нестандартного водородного электрода:
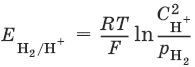
Каломельный электрод состоит из ртутного электрода, помещенного в раствор KCl, определенной концентрации и насыщенный каломелью Hg2Cl2:
Hg / Hg2Cl2, KCl
Каломельный электрод обратим относительно анионов хлора
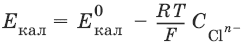
Хлорсеребряный электрод – обратим относительно анионов хлора:
Ag / AgCl, KCl
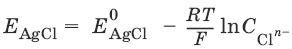
Если раствор KCl – насыщенный, то EAgCl = 0,2224 – 0,00065(t – 25), В.
Индикаторные электроды. Электроды, обратимые относительно иона водорода, используются на практике для определения активности этих ионов в растворе.
Хингидронный электрод представляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещают избыточное количество хингидрона С6Н4O2 • С6Н4(OH)2 – соединения хинона С6Н4O2 и гидрохинона С6Н4(OH)2, способных к взаимопревращению в равновесном окислительно-восстановительном процессе, в котором участвуют ионы водорода:
С6Н4O2 + 2H+ + 2е¯ → С6Н4(OH)2
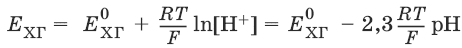
Наиболее часто употребляется стеклянный электрод в виде трубки, оканчивающейся тонкостенным стеклянным шариком. Шарик заполняется буферным раствором с определенным значением рН, в который погружен вспомогательный электрод (обычно хлорсеребряный). Для измерения рН стеклянный электрод погружают в исследуемый раствор в паре с электродом сравнения. Шарик стеклянного электрода предварительно обрабатывают в течение длительного времени раствором кислоты. При этом ионы водорода внедряются в стенки шарика, замещая катионы щелочного металла. Электродный процесс сводится к обмену ионами водорода между двумя фазами – исследуемым раствором и стеклом: Нр-р ↔ Нст+.
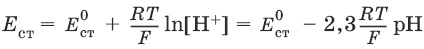
Стандартный потенциал Е ст0 для каждого электрода имеет свою величину, которая со временем изменяется; поэтому стеклянный электрод перед каждым измерением рН калибруется по стандартным буферным растворам с точно известным рН.
Дата добавления: 2016-04-23; просмотров: 1112;
