Виды коагуляции электролитами
Концентрационная коагуляция наступает под действием индифферентных электролитов. Индифферентным называется электролит, при введении которого межфазный потенциал <р не изменяется. Данный электролит не содержит таких ионов, которые были бы способны к специфической адсорбции на частицах по правилу Па-нета-Фаянса, т. е. не способны достраивать кристаллическую решетку агрегата:

Состояние, при котором диффузный слой исчезнет и коллоидная частица становится электронейтральной, называется изоэлектрическим – электрокинетический потенциал (ζ) равен нулю, наступает коагуляция. Формула мицеллы в таком состоянии приобретает вид: m[AgI]nAg+nNO3¯0.
Нейтрализационная коагуляция происходит при добавлению к золю неиндифферентного электролита. Неиндифферентным называется электролит, способный изменить межфазный (φ) и линейно с ним связанный электрокинетический (ζ) потенциалы, т. е. данный электролит содержит ионы, способные специфически адсорбироваться на поверхности агрегата, достраивать его кристаллическую решетку или химически взаимодействовать с потенциалоп-ределяющими ионами.
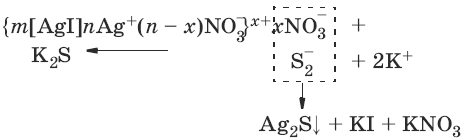
Обратимый процесс, при котором коагулят вновь переходит в коллоидное состояние, называется пептизацией или дезагрегацией.
Правила коагуляции
1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию. Минимальная концентрация электролита, вызывающая коагуляцию золя за определенный короткий промежуток времени, называется порогом коагуляции:
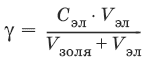
где Сэл – концентрация электролита-коагулятора; V эл – объем добавленного электролита; V золя(обычно 10 мл) – объем золя.
2. Коагулирующим действием обладает тот ион, заряд которого совпадает по знаку с зарядом противоионов мицеллы лиофобного золя (заряд коагулирующего иона противоположен заряду коллоидной частицы). Этот ион называют ионом-коагулянтом.
3. Коагулирующая способность иона – коагулянта тем больше, чем больше заряд иона:
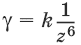
Правило значности:
γ1 : γ2 : γ3 = 1/16 : 1/26 : 1/36 = 729 : 11 : 1
Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Ag+ > Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+ – лиотропный ряд.
Коллоидной защитой называется повышение агрегативной устойчивости золя путем введения в него ВМС (высокомолекулярное соединение) или ПАВ (поверхностно-активного вещества).
Защитным числом называется минимальное количество миллиграммов сухого вещества, которое необходимо для защиты 10 мл золя при добавлении к нему электролита в количестве, равном порогу коагуляции.
Дата добавления: 2016-04-23; просмотров: 1422;
