Классификация веществ по влиянию на поверхностное натяжение растворителя
1. Поверхностно-активные вещества (ПАВ) – понижают поверхностное натяжение растворителя (σр-р < σ0) g > 0 (по отношению к воде – органические соединения дифильного строения).
2. Поверхностно-инактивные вещества (ПИВ) – незначительно повышают поверхностное натяжение растворителя (σр-р > σ0) g < 0 (неорганические кислоты, основания, соли, глицерин, α-аминокислоты и др).
3. Поверхностно-неактивные вещества (ПНВ) – практически не изменяют поверхностного натяжения растворителя (σр-р = σ0) g = 0 (по отношению к воде веществами являются сахароза и ряд других).
Правило Дюкло-Траубе: в любом гомологическом ряду при малых концентрациях удлинение углеродной цепи на одну группу CH2 увеличивает поверхностную активность в 3–3,5 раза:
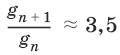
Для водных растворов жирных кислот (уравнение Шишковского):
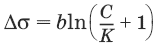
где b и К – эмпирические постоянные, b одинаково для всего гомологического ряда, К увеличивается для каждого последующего члена ряда в 3–3,5 раза.
Процесс самопроизвольного изменения концентрации какого-либо вещества у поверхности раздела двух фаз называется адсорбцией. Адсорбентом называется вещество, на поверхности которого происходит изменение концентрации другого вещества – адсорбата.
Изотерма адсорбции Гиббса:
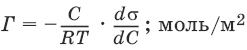
Избыток адсорбата в поверхностном слое по сравнению с его первоначальным количествам в этом слое характеризует избыточную, или так называемую гиббсов-скую, адсорбцию (Г).
6.2. Адсорбция на границе твердое тело – газ
Физическая адсорбция возникает за счет ван-дер-ваальсовых взаимодействий адсорбированной молекулы с поверхностью, характеризуется обратимостью и уменьшением адсорбции при повышении температуры, т. е. экзотермичностью (тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата 10–80 кДж/моль).
Химическая адсорбция (хемосорбция) осуществляется путем химического взаимодействия молекул адсорбента и адсорбата, обычно необратима; является локализованной, т. е. молекулы адсорбата не могут перемещаться по поверхности адсорбента. Так как хемосорбция является химическим процессом, требующим энергии активации порядка 40-120 кДж/моль, повышение температуры способствует ее протеканию.
Уравнение Генри (мономолекулярная адсорбция на однородной поверхности при низких давлениях или малых концентрациях):
Г = Кс или Г = Кр,
К – константа адсорбционного равновесия, зависящая от природы адсорбента и адсорбата; С, р – концентрация растворенного вещества или давление газа.
Теория мономолекулярной адсорбции Лэнгмюра
1. Адсорбция является локализованной и вызывается силами, близкими к химическим.
2. Адсорбция происходит на однородной поверхности адсорбента.
3. На поверхности может образоваться только один слой адсорбированных молекул.
4. Процесс адсорбции является обратимым и равновесным.
Изотерма адсорбции Лэнгмюра:
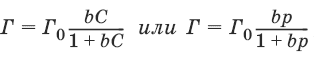
где Г0 – емкость монослоя – константа, равная предельной адсорбции, наблюдаемой при относительно больших равновесных концентрациях, моль/м2; b – константа, равная отношению константы скорости адсорбции и константе скорости десорбции.
Уравнение Фрейндлиха (адсорбция на неоднородной поверхности): Г = КФсn, где. КФ – константа, численно равная адсорбции при равновесной концентрации, равной единице; n – константа, определяющая кривизну изотермы адсорбции (n = 0,1–0,6).
Молекулярная адсорбция из растворов:
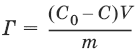
где С0 – исходная концентрация адсорба-та; С – равновесная концентрация адсорбата; V – объем раствора адсорбата; m – масса адсорбента.
Площадь S0, приходящаяся на одну молекулу в насыщенном адсорбционном слое, – посадочная площадка:
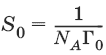
м2/молекула.
Толщина адсорбционного слоя:
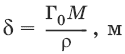
где М – молекулярная масса ПАВ; ρ – плотность ПАВ.
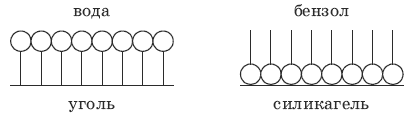
Правило Ребиндера: на полярных адсорбентах лучше адсорбируются полярные ад-сорбаты из малополярных растворителей; на полярных адсорбентах – неполярные адсорбаты из полярных растворителей.
Ориентация молекул ПАВ на поверхности адсорбента схематически изображена на рисунке:
Дата добавления: 2016-04-23; просмотров: 2558;
