Метод валентных связей
Согласно методу валентных связей, связь между атомами А и В образуется с помощью общей пары электронов.
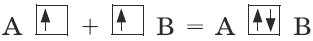
Ковалентная связь.
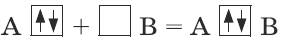
Донорно-ацепторная связь.
Валентность характеризует способность атомов образовывать химические связи и равна числу химических связей, образованных атомом. Согласно методу валентных связей, валентность равна числу общих пар электронов, а в случае ковалентной связи валентность равна числу неспаренных электронов на внешнем уровне атома в его основном или возбужденных состояниях.
Валентность атомов
Например, для углерода и серы:
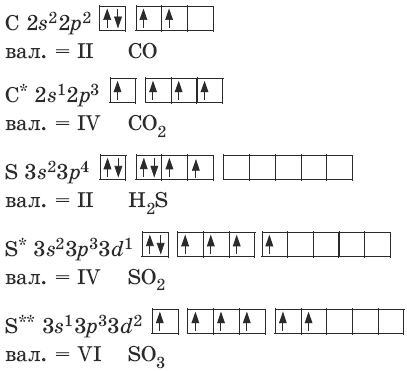
Насыщаемостьковалентной связи: атомы образуют ограниченное число связей, равное их валентности.
Гибридизация атомных орбиталей– смешение атомных орбиталей (АО) разных подуровней атома, электроны которых участвуют в образовании эквивалентных σ-связей. Эквивалентность гибридных орбиталей (ГО) объясняет эквивалентность образующихся химических связей. Например, в случае четырехвалентного атома углерода имеется один 2s– и три 2p -электрона. Чтобы объяснить эквивалентность четырех σ-связей, образованных углеродом в молекулах CH4, CF4 и т. д., атомные одна s- и три р- орбитали заменяют четырьмя эквивалентными гибридными sp3 -орбиталями:

Направленностьковалентной связи состоит в том, что она образуется в направлении максимального перекрывания орбиталей, образующих общую пару электронов.
В зависимости от типа гибридизации гибридные орбитали имеют определенное расположение в пространстве:
sp – линейное, угол между осями орби-талей 180°;
sp2 – треугольное, углы между осями орбиталей 120°;
sp3 – тетраэдрическое, углы между осями орбиталей 109°;
sp3d1 – тригонально-бипирамидальное, углы 90° и 120°;
sp2d1 – квадратное, углы между осями орбиталей 90°;
sp3d2 – октаэдрическое, углы между осями орбиталей 90°.
Дата добавления: 2016-04-23; просмотров: 1048;
