Действие некоторых реагентов на катионы VI аналитической группы
Cu2+ , Hg2+ , Co2+ , Ni2+
| Реагент | Катионы | |||
| Cu2+ | Hg2+ | Co2+ | Ni2+ | |
| NaOH или KOH | Cu(OH)2 голубой осадок | Hg(OH)2 белый осадок, разлагается до HgO. Желтый осадок. | Co(OH)Cl синий осадок | Ni(OH)2 зеленый осадок |
| Осадки растворяются в кислотах и в избытке раствора аммиака | ||||
| Основные соли и амидные соединения | ||||
| NH3 * H2O без избытка | Cu(OH)2SO4↓ и др. зеленый | NH2HgCl↓ белый | Co(OH)Cl↓ и др. синий | (NiOH)2SO4↓ и др. зеленый |
| Осадки растворяются в избытке реактива | ||||
| NH3 * H2O в избытке | [Cu(NH3)4]2+ - синий | [Hg(NH3)4]2+ бесцветный | [Co(NH3)6]2+ оранжево-коричневый | [Ni(NH3)6]2+ сиреневый |
| Разрушаются кислотами | ||||
| Na2S2O3 | Cu2S↓ черный + S↓ растворяется в HNO3 | HgS черный, растворяется в бромной воде | - | - |
| KI | CuI белый + +I2 бурый | HgI2 оранжево-красный, растворяется в избытке реагента | - | - |
| (NH4)2NCS | Cu(NCS)2↓ черный, который постепенно превращается в белый CuNCS↓ | Hg(NCS)2↓ белый, растворимый в избытке реагента с образованием [Hg(NCS)4]2ˉ бесцветный | (NH4)2[Co(NCS)4] синий цвет | - |
| SnCl2 | Cu↓ | Hg↓ | - | - |
Схема систематического хода анализа катионов VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+
Этапы исследования
1. Взаимодействие катионов VI аналитической группы с групповым реагентом (избыток NH3*H2O):
Cu2+ изб.NH3*H2O [Cu(NH3O)4]2+
Hg2+ изб.NH3*H2O [Hg(NH3O)4]2+
Co2+ изб.NH3*H2O [Co(NH3O)6]2+
Ni2+изб.NH3*H2O [Ni(NH3O)6]2+
2. Разрушение аммиакатов действием 2 моль/дм3 H2SO4
3. Отделение Cu2+ и Hg2+ ионов от других катионов VI
аналитической группы действием Na2S2O3 на раствор №2:
Cu2+ Na2S2O3;Δ Cu2S↓ + S↓
Hg2+ Na2S2O3;Δ HgS↓
4. Отделение Cu2Sот HgSпри частичном растворении осадка №3 в разб. HNO3 при нагревании:
Cu2S↓ HNO3;Δ Cu2+
5. Определение Cu2+ ионов в растворе №4 действием
концентрированного NH3 * H2O:
Cu2+ NH3*H2O [Cu(NH3)4]2+
6. Растворение осадка № 4 действием бромной воды в присутствииHClили в «царской водке»:
HgS↓ Br;HCl [HgCl2] + S↓
HgS↓ конц.HNO3,конц. HCl [HgCl2]
7. Отделение [HgCl2] от S↓ центрифугированием.
8. Определение Hg2+ ионов в центрифугате №7 действием раствора SnCl2:
[HgCl2] SnCl2 Hg↓
9. Определение Co2+ ионов в центрифугате №3 действием раствора NH4NCS в присутствии амилового спирта:
Co2+ NH4NCS (NH4)2[Co(NCS)4]
C5H11OH
10. Определение Ni2+ ионов в центрифугате №3 действием реактива Чугаева (диметилглиоксима):
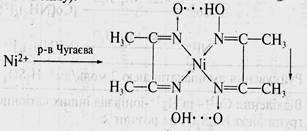
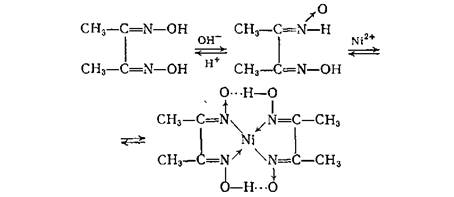
Схема систематического хода анализа катионов III аналитической группы Ba2+, Sr2+, Ca2+
Этапы исследования
1.Осаждение катионов III аналитической группы действием 1 моль/дм3 H2SO4 в присутствии C2H5OH при нагревании:
Ba2+ H2SO4, Δ BaSO4↓
Sr2+ H2SO4, Δ SrSO4↓
Ca2+ H2SO4, C2H5OH, Δ CaSO4↓
Промывание осадка водой, которая содержит H2SO4
2.Переосаждение осадков сульфатов катионов III аналитической группы в осадки их карбонатов действием насыщенного раствора Na2CO3 при кипячении:
BaSO4↓ Na2CO3, Δ BaCO3↓
SrSO4↓ Na2CO3, Δ SrCO3↓
CaSO4↓ Na2CO3, Δ CaCO3↓
Промывание осадка водой
3.Растворение осадка №2 действием раствора СН3СООН:
BaCO3↓ СН3СООН Ba2+
SrCO3↓ СН3СООН Sr2+
CaCO3↓ СН3СООН Ca2+
4.Выявление Ba2+ катиона в отдельной порции раствора №3 действием раствора K2CrO4:
Ba2+ K2CrO4 BaCrO4↓
Если присутствие Ba2+ катиона доказано, то его извлекают из раствора №3 действием раствора K2CrO4
5.Выявление Sr2+ катиона в отдельной порции центрифугата №4 действием насыщенного раствора кальция сульфата (гипсовая вода):
Sr2+ насыщ. раствор CaSO4 SrSO4↓
гипсовая вода
6.Удаление Sr2+ катионов из центрифугата №4 действием конц. раствора (NH4)2SO4:
Sr2+ конц. (NH4)2SO4 SrSO4↓
Ca2+ конц. (NH4)2SO4 [Ca(SO4)2]2ˉ
7.Выявление Ca2+ катиона в центрифугате № 6 действием раствора (NH4)2С2O4 :
Ca2+ (NH4)2С2O4 СаС2О4↓
СН3СООН
Дата добавления: 2016-11-02; просмотров: 3650;
