РОЛЬ СИЛЬНО АДСОРБИРУЮЩИХСЯ ПРИМЕСЕЙ
ПРИ КРИСТАЛЛИЗАЦИИ
На поверхности кристалла адсорбированы частицы практически всех разновидностей, имеющихся в среде. Во время роста между ними идет постоянная борьба за место на поверхности.
В первом приближении концентрация частиц данного сорта на поверхности тпов (в мольных долях) определяется выражением
mпов = gm exp (QRT),
где т — концентрация этих частиц в растворе; Q — теплота (энергия) их адсорбции; g — постоянный множитель [Герасимов Я. И. и др., 1969 г.].
Из этой формулы видно, что соотношение площадей, занимаемых частицами разного сорта на поверхности, в первую очередь определяется энергиями адсорбции и лишь во вторую — концентрациями их в среде.
Так как грани разных кристаллографических форм различаются потенциальным рельефом, то энергия адсорбции одних и тех же частиц на разных гранях имеет различные значения, или, как говорят, адсорбция на гранях разных кристаллографических форм специфична. Так, найдено, что теплота адсорбции молекул воды на гранях пинакоида кристаллов льда равна ~38 кДж/моль, на гранях призмы— ~34 кДж/моль.
Поскольку величина теплоты адсорбции положительна (тепло выделяется), при повышении температуры экспоненциальный сомножитель в приведенной формуле уменьшается, адсорбция падает с увеличением температуры. Однако энергия связи частиц с поверхностью может быть столь велика, что в ряде случаев адсорбируемая частица вообще не десорбируется без разрушения структуры подложки. Так, адсорбированную воду нельзя полностью удалить с поверхности NaCl, BaCl2, CaF2 нагреванием в вакууме.
При температуре около 500°С происходят химические реакции, в результате которых выделяются соответствующие кислоты[ДеБур Я. X., 1959].
Среднее время пребывания адсорбированной частицы (время жизни) на поверхности от момента адсорбции до момента десорбции равно
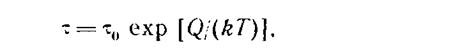
где τ0 — период колебания частицы, τ0~10-13 с; k — константа Больцмана. В течение времени τ частица может либо оставаться на том месте, где она адсорбировалась, либо перемещаться по поверхности. Соответственно различают неподвижную (локализованную) и подвижную адсорбцию. Влияние примесей на рост кристаллов в этих двух случаях будет различным.
Если адсорбированная частица практически не мигрирует по поверхности, то в этом случае τ будет временем, в течение которого, во-первых, место, занятое данной посторонней частицей, не может быть занято собственной частицей кристалла; во-вторых, из-за искажения потенциального рельефа поверхности не может происходить нормального заполнения ближайших мест приложения.
|
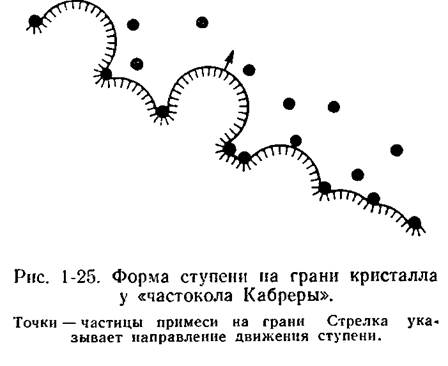
Очень прочно адсорбированные на грани частицы (с большим τ) являются для ступеней препятствием, называемым «частоколом Кабреры». Ступень роста может двигаться по поверхности, только проникая между частицами, образующими «частокол», и охватывая их (рис. 1-25). Частицы, которые ступень обошла, оказываются включенными в кристалл. Если среднее расстояние между частицами примеси меньше диаметра двумерного критического зародыша, ступени роста останавливаются и скорость роста такой «отравленной» грани падает до нуля. Если же при данной концентрации примеси на поверхности увеличить пересыщение (вследствие чего уменьшится размер критического зародыша), ступень начнет двигаться. Таким образом, существует критическое пересыщение, до которого скорость роста равна нулю (область заторможенного роста пли «мертвая зона»). Чем выше содержание данной примеси в растворе, тем больше критическое пересыщение (рис. 1-26).
Так как с повышением температуры адсорбция примесей ослабляется, область заторможенного роста сужается.
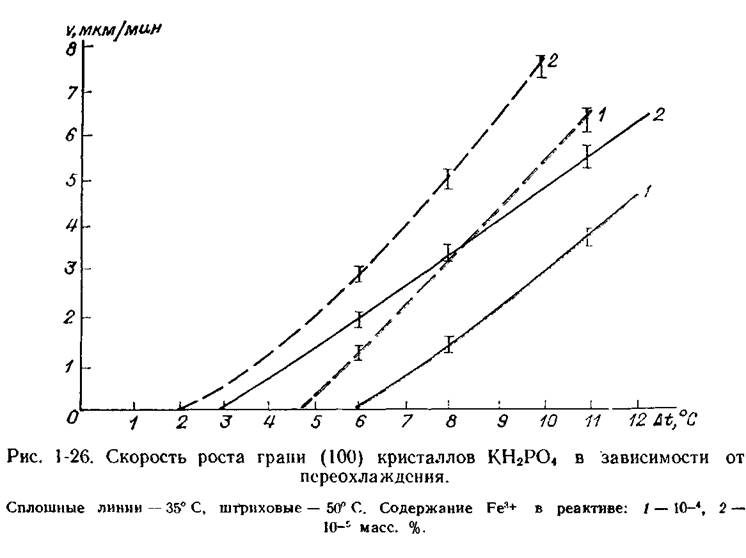
Во многих случаях эту область можно ликвидировать увеличением температуры.
Если адсорбция специфична, отравляются грани только некоторых простых форм, и резко меняется габитус. Так, кристаллы КН2РО4, растущие из чистых растворов короткопризматическими, с примесями ионов тяжелых металлов дают кристаллы вытянутого, игольчатого габитуса, поскольку рост граней призмы полностью заторможен, а на грани дипирамиды воздействие примесей сказывается слабо. Одновременное наличие таких примесей приводит к выклиниванию кристаллов (см. ниже). Если адсорбция неспецифична, могут измениться существенно скорости роста всех граней приблизительно на одно и то же значение, что также будет сопровождаться изменением облика кристаллов.
Извилистый контур ступени роста, возникающий в случае островного (локального) покрытия примесью поверхности, может приводить к захвату кристаллом множества микроскопических включений раствора, аналогично описанному в § 1.6. В крайних случаях, при большой концентрации включений, это вызывает появление непрозрачных кристаллов. Так, азотнокислый свинец из чистого водного раствора растет в виде фарфоровидных кристаллов, по-видимому, из-за отравления поверхности менее растворимой основной солью Pb(OH)N03 [в присутствии HN03 кристаллы Pb(NO3)2 растут прозрачными].
Локализованной адсорбцией отличаются крупные органические молекулы, неорганические коллоидные примеси, а также в некоторых случаях многозарядные ионы.
|
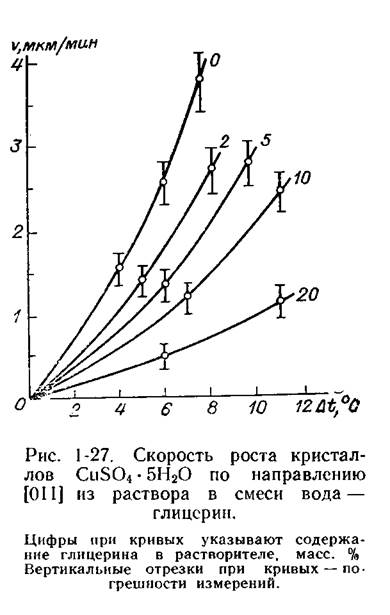
Если адсорбция примесей не-локализована, такие примеси, адсорбированные на гладких участках грани, не могут быть частоколом перед ступенями. Однако в изломах на ступенях они могут адсорбироваться достаточно прочно. При этом число свободных, доступных для основного вещества изломов снижается, и скорость движения ступени по грани уменьшается. Соответственно происходит и уменьшение скорости роста грани. Однако в отличие от случая неподвижной адсорбции отравление изломов не приводит к полному торможению грани, так как всегда возможен обмен между частицами примеси, адсорбировавшимися в изломах, и частицами основного вещества. Кроме того, все время флуктуативно возникают новые изломы. На рис. 1-27 дан график изменения скорости роста кристаллов CuS04*5H20 при разных концентрациях глицерина, видимо отравляющего изломы. Как и примеси, локализованные на поверхности, примеси, отравляющие изломы, могут адсорбироваться специфически, меняя габитус кристаллов. Глицерин приводит к резкому уплощению кристаллов CuS04 • 5Н2О по грани (111).
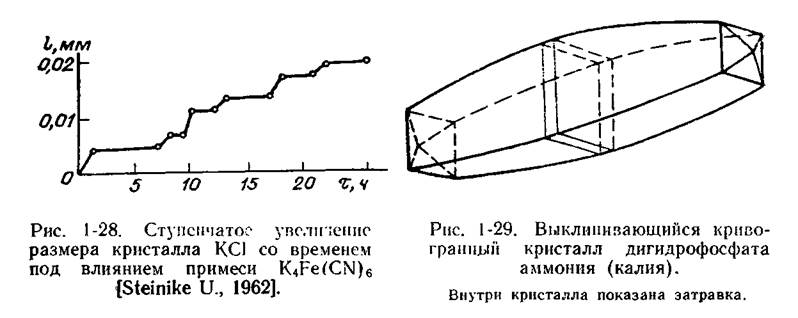
Адсорбция локализованной примеси может приводить к колебаниям скорости роста, что, видимо, особенно характерно для эпитаксиальной примеси. Так, добавка ничтожных количеств желтой кровяной соли к раствору приводит к тому, что периоды роста кристаллов КС1 начинают чередоваться с периодами полной остановки роста (рис. 1-28). При этом нарастание слоя основного вещества перемежается образованием ориентированного слоя из мельчайших кристалликов желтой кровяной соли. Возникают аномально-смешанные кристаллы.
Выше говорилось о торможении роста кристаллов примесями. Однако известны и случаи увеличения скорости роста под влиянием примесей. Более того, одна и та же примесь может в малых количествах увеличивать скорость роста, а в больших — тормозить ее. Возможно, повышение скорости роста связано с уменьшением поверхностной энергии ступени (так называемой краевой энергии ступени) при адсорбции на ней примесей, так как известно, что адсорбция уменьшает поверхностную энергию. При этом уменьшается связанный с поверхностной энергией размер двумерного критического зародыша. Следовательно, облегчается его возникновение.
По-видимому, комбинированное воздействие примесей (уменьшение краевой энергии ступеней и одновременно торможение распространения ступеней) вызывает обычно наблюдаемое образование сильно выпуклых вицинальных холмов. Часто при этом грани приобретают общее искривление, обусловленное тем, что центральные участки грани обгоняют в росте приреберные. Такой рост называют «антискелетным». При нем искривление граней не сопровождается искажением решетки кристалла.
При резком различии в скоростях роста искривленных и плоских поверхностей, которые присутствуют на кристалле одновременно, антискелетный рост может приводить к «выклиниванию» кристаллов (дигидрофосфат калия и дигидрофосфат аммония — рис. 1-29).
Очень сильная адсорбция поверхностно-активных примесей может приводить к тому, что рост будет происходить только у выходов дислокаций. На грани кристалла при этом возникнут усы, или нитевидные выросты, за счет чего при дальнейшем росте и неточном смыкании этих выростов могут развиваться макроблочность [Пунин Ю. О. и др., 1973] или формы, внешне не отличимые от обычных скелетных форм. Образование нитевидных выростов наблюдается на кристаллах галогенидов щелочных металлов, адипиновой кислоты, КН2Р04, К2CrO4 и других веществ в присутствии некоторых примесей.
С накоплением примеси на поверхности кристалла в течение роста, видимо, связаны известные случаи падения скорости роста со временем практически до нуля.
Примеси могут влиять на скорости роста кристаллов в чрезвычайно малых концентрациях. Так, используемые при производстве КС1 и остающиеся в реактивах примеси аминов в количестве всего 10-5—10-6% по массе меняют огранку кристаллов с кубической на октаэдрическую и приводят к резко выраженному отравлению граней, проявляющемуся в том, что кристаллы не растут в широкой области пересыщений. Многочисленные примеры резкого воздействия ничтожных концентраций примеси на рост кристаллов (1 и меньше частиц на миллион) указаны у Г. Бакли [1954].
Для оценки адсорбируемости, пожалуй, наиболее простым и надежным является правило Панета, согласно которому на кристалле наиболее прочно адсорбируются те частицы, которые дают с частицами кристалла наименее растворимое соединение. Можно предвидеть, например, что ион К+ в растворе NaBr03 в силу меньшей растворимости КВr03 будет сравнительно энергично адсорбироваться на кристаллах NаВrОз, а следовательно, и влиять на их рост, в то время как примесь такого же количества ионов С1- существенно не повлияет на процесс из-за сравнительно большой растворимости NaCl.
Растворимость кислых, нормальных и основных солей обычно существенно различается. Поэтому изменение кислотности — щелочности (значения рН) среды, приводя к смещению химического равновесия в растворе, будет влиять на адсорбционный процесс согласно правилу Панета. Так, кристаллы А1 - К-квасцов при введении группы ОН- в раствор уменьшают скорость роста [Порт-нов В. Н., Белюстин А. В., 1965]. Этого и следовало ожидать, так как при этом должна образовываться плохо растворимая гидроокись алюминия. Соответственно, если рост тормозится образованием плохо растворимого соединения на поверхности, а изменение кислотности сдвигает равновесие реакции в сторону образования более растворимого соединения, то скорость роста кристалла будет увеличиваться. В других случаях изменение рН может приводить просто к удалению примеси из раствора в виде нерастворимого осадка. Так, добавка щелочи к растворам солей типа КН2Р04 переводит трехвалентные катионы в гидроокиси. Возможно также изменение состояния примеси в растворе. Например, при увеличении рН высокомолекулярные амины переходят из солевой формы в нейтральную и их адсорбируемость на кристаллах КС1 падает.
Среди органических примесей обычно сильно адсорбируются красители [Бакли Г., 1954]. Причина этого, по-видимому, заключается в том, что окрашенность соединения связана с его химической ненасыщенностью — наличием нечетного числа электронов в молекуле, а это последнее и обусловливает повышенную адсорбционную способность таких веществ.
Известно большое число поверхностно-активных органических веществ, которые благодаря наличию у них полярных, групп хорошо адсорбируются на разнообразных неорганических поверхностях [Поверхностно-активные вещества, 1979 г.]. Эти вещества следует иметь в виду при поисках примесей, воздействующих на рост кристаллов. Кроме уже упоминавшихся аминов к таким веществам относятся различные мыла, карбоновые кислоты, высокомолекулярные спирты и пр.
В ряде случаев замечено, что если соединение неустойчиво и разлагается, пусть с небольшой скоростью, то кристаллы растут медленно, со множеством дефектов. Мы связываем это с высокой химической активностью промежуточных продуктов реакции именно в момент прохождения реакции разложения, т. е пока эти продукты находятся в растворе и на поверхности кристалла в виде радикалов.
Согласно теории, на равновесной поверхности раздела двух фаз концентрируются те вещества, которые слаборастворимы в обеих фазах. Именно такие вещества уменьшают поверхностную энергию границы раздела и являются поверхностно-активными. Указанное правило может быть использовано для выявления поверхностно-активных веществ при выращивании кристаллов. Из этого правила следует также, что для подавления действия неизвестной нам вредной примеси можно попытаться добавить в раствор некоторое количество того или иного растворителя, обладающего хорошими растворяющими свойствами.
Особенно эффективно воздействуют на рост примеси, кристаллы которых нарастают на кристалл-подложку эпитаксично, пример чему приводился выше. Однако надежных признаков для предсказания эпитаксии нет. Сходство рисунка в расположении частиц и расстояний между ними в контактирующих поверхностях как условие эпитаксии не является универсальным. Списки эпитаксиальных примесей, найденных на опыте, собраны в специальном томе справочника X. Ландольта и Р. Бернштейна [Landolt H., Bornstein R., 1972 г., Bd. 8].
О том, что в качестве вещества, энергично адсорбирующегося на гранях кристалла, выступает и растворитель, свидетельствуют наблюдающиеся иногда различия облика кристаллов органических веществ, выращенных из разных растворителей, а также результаты изучения роста кристаллов из водных растворов. Исходя из представлений об эпитаксиальной адсорбции растворителя на гранях, удалось объяснить наблюдаемое соотношение скоростей роста граней разных простых форм кристаллов нитрата калия [Петров Т. Г., 1964] и кварца [Чернов А. А., Кузнецов В. А., 1969], а также температурную зависимость скоростей роста и различие в интенсивности захвата включений раствора пирамидами роста разных граней (§ 1.8).
Отметим, что изоморфная примесь не является поверхностно-активным веществом, так как она близка по своим свойствам к веществу кристалла.

 рис. 1-30, а. Здесь в качестве основного компонента кристалла выступает вещество В, в качестве примеси — вещество А. Если же примесь повышает температуру плавления, то k0>1. Этому случаю соответствует пара составов 1б—2б на том же рисунке. Теперь в качестве основного компонента выступает вещество А, в качестве примеси — вещество В.
рис. 1-30, а. Здесь в качестве основного компонента кристалла выступает вещество В, в качестве примеси — вещество А. Если же примесь повышает температуру плавления, то k0>1. Этому случаю соответствует пара составов 1б—2б на том же рисунке. Теперь в качестве основного компонента выступает вещество А, в качестве примеси — вещество В.
При росте кристалла из раствора с числом компонентов больше двух (в частности, при росте трехкомпонентных растворов: растворитель — основное вещество M —примесь т) коэффициент распределения определяется как двойное отношение
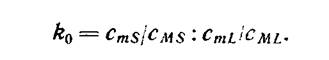
Здесь S по-прежнему относится к твердой фазе, L — к жидкости, т. е. cML и сmL — растворимость основного вещества и примеси.
В этом случае составы растворов и равновесных с ними кристаллов также удобно изображать в виде графика, пример которого приведен на рис. 1-30, б. Здесь по оси абсцисс откладывается процентное содержание (или доля) одного из компонентов в общей массе содержащихся в растворе солей и в кристалле, а по оси ординат — суммарная концентрация солей в растворе («солевая масса» раствора). Очевидно, что количество каждой из солей в насыщенном растворе легко определить из указанных на графике двух величин: общей массы растворенных веществ и доли одного из них в этой массе.
Кривую S, соответствующую твердой фазе, строят на этом графике, зная состав кристаллов и солевую массу равновесных с ними растворов L. Такие диаграммы наглядно показывают особенности конкретных систем. Так, в случае пары точек равновесных между собой составов, соединенных на рис. 1-30, б штриховой линией, насыщенный раствор, содержащий в солевой массе 53 мольн.% хлористого аммония, находится в равновесии с кристаллами, содержащими 8 мольн. % NH4C1.
Как видно из рис. 1-30, б, хлористый аммоний в кристаллы КС1, равно как и хлористый калий в кристаллы NH4C1, способны входить лишь в ограниченных количествах.
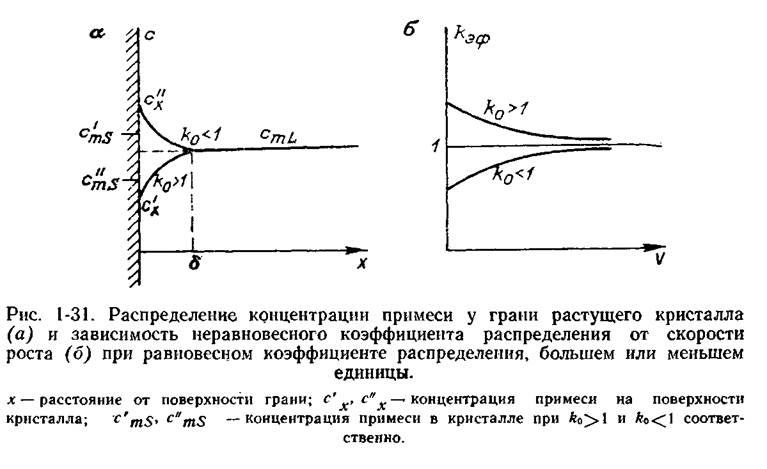
Захват примеси кристаллом приблизительно соответствует равновесной диаграмме состояния только при очень медленном его росте. Если же скорость роста не является малой, то при k0<1 отталкиваемая примесь не успевает равномерно распределиться по объему жидкости. В результате вблизи растущей грани кристалла концентрация этой примеси оказывается повышенной (рис. 1-31, а, верхняя кривая). Соответственно больше и количество примеси, входящей в кристалл, по сравнению с ее равновесным содержанием в кристалле. Поскольку мы рассчитываем коэффициент распределения, исходя из экспериментально определенной концентрации примеси в жидкости и в кристалле, то при k0< 1 получаем эффективный (неравновесный) коэффициент распределения, больший, чем равновесный: kэф>kо.
Захват примеси зависит от скорости роста. Чем больше скорость роста, тем большее количество примеси оттесняется, тем выше ее концентрация на поверхности и тем ближе kэф к 1 (рис. 1-31,6).
Если kо> 1, т. е. кристалл захватывает примесь в большем количестве, чем она содержится в окружающей среде, то слой раствора около кристалла при его росте обедняется примесью (рис. 1-31, а, нижняя кривая). Соответственно меньше примеси входит и в кристалл. В результате неравновесный коэффициент распределения примеси меньше, чем равновесный. Причем, чем больше скорость роста, тем беднее приграничный слой раствора примесью. Таким образом, как и в случае с kо<1. в данном случае коэффициент распределения kэф также стремится к 1 с увеличением скорости роста.
Увеличение эффективного коэффициента распределения по сравнению с равновесным при k0< 1 происходит также за счет адсорбции. При сильной адсорбции примесь захороняется нарастающими слоями, не успев десорбироваться. Чем больше скорость роста и чем выше энергия адсорбции примеси, тем выше вероятность захвата адсорбированных частиц кристаллом. В отличие от описанных выше диффузионных эффектов сильная адсорбция может приводить к kэф> 1 и при kо<1. В практике выращивания монокристаллов из низкотемпературных растворов такие случаи довольно часты. Поскольку k0 бывает больше 1 только для изоморфной примеси, а эффективно влияет на рост адсорбционно-активная неизоморфная примесь, то описанные случаи легко распознаются при очистке веществ путем перекристаллизации (§ 4.1), когда обнаруживается, что прямая перекристаллизация не очищает, а загрязняет вещество (загрязнение вещества устанавливается по уменьшению скоростей роста кристалла и ухудшению его качества).
Для неравновесных условий диаграмма состояния видоизменяется. Составы растворов, переохлажденных на одинаковое значение, изображают в виде кривой L' (рис. 1-30,а). Составы кристаллов, образующихся из переохлажденных растворов L', отражает на рис. 1-30,а кривая S'. При увеличении переохлаждения кривая L' смещается вниз, а кривая S' ввиду того, что кэф стремится к 1, сближается с кривой L' и в пределе сливается с нею. Положение кривой S' при данном положении кривой L' зависит от интенсивности перемешивания раствора, и, согласно рис. 1-31,а, сх должна стремиться при перемешивании к cmL, а kэф — к некоторому предельному коэффициенту распределения.
Заметим, что диаграмма неравновесных величин L' — S' называется кинетической. Такая диаграмма может быть построена и для трехкомпонентных систем, таких как на рис. 1-30,б.
Из-за различных скоростей роста и различных энергий адсорбции примесь входит в пирамиды роста граней разных кристаллографических форм в разных количествах. В связи с этим физические свойства пирамид могут весьма сильно различаться. Так, если разрезать кристалл нормально к его граням, отполировать и протравить образовавшиеся поверхности, то довольно часто обнаруживается, что вещество разных пирамид роста растворяется с разной скоростью. Материал из разных пирамид роста обычно различается по твердости, показателю преломления, иногда по цвету и т. д.
В отдельный сектор примесь может входить неравномерно на разных этапах роста кристалла, что приводит к его зональному строению. Главной причиной зональности являются колебания скоростей роста граней по тем или иным причинам, в первую очередь в результате непостоянства условий ведения процесса (температуры, пересыщения). Частным случаем зональных кристаллов являются аномально-смешанные кристаллы с прослойками эпитаксиальной примеси (§ 1.1 и 1.7).
Наконец, примесь входит неравномерно по площади грани. Разноориентированные вицинальные поверхности, образующие холмики роста, поглощают примесь в разных количествах. При этом возникает субсекториальность в распределении примеси в кристаллах. Характерно также повышенное содержание примеси на стыках слоев роста от соседних центров роста.
Различия в содержании примесей в разных участках кристалла приводят и к различиям в параметрах элементарной ячейки структуры кристалла в разных его участках. Это явление получило название «гетерометрии» [Штернберг А. А., 1962] и широко распространено в природных и искусственных кристаллах. Гетерометрия приводит к местным напряжениям внутри кристалла, которые проявляются различно. Так, при неравномерном вхождении примеси в отдельную пирамиду роста могут возникать дислокации. Дислокации возникают и при разрешении напряжений между соседними пирамидами роста.
Пластическая деформация за счет внутренних напряжений (автодеформация) может приводить к изгибу и скручиванию кристаллов в процессе роста (Бакли Г., 1954]. Мы сталкивались со скручиванием или изгибом при росте кристаллов щавелевой и янтарной кислоты, сегнетовой соли, медь-аммоний сульфата, гипса. Необходимо отличать истинное скручивание и изгиб от образования кривогранного кристалла, не имеющего искажения решетки
(§ 1.7).
| Рис. 1-32. Субиндивиды разной формы в теле материнского кристалла. |
Поскольку пластическая деформация возникает одновременно с ростом, образующиеся в ходе деформации микроблоки, выходящие на поверхность кристалла, могут начать расти самостоятельно за счет собственных центров роста, давая субиндивиды в теле основного кристалла (рис. 1-32). При этом происходит быстрое разрастание блоков до макроскопических размеров (рис. 1-33) [Ульянова Т. П. и др. 1973]. Кристаллизационное давление, развивающееся по индукционным поверхностям между основным кристаллом и блоком, создает новые напряжения, и возникают новые блоки. Таким образом, происходит прогрессивное нарастание блочности, причем каждый блок по-прежнему растет как самостоятельный кристалл. Такой процесс называется расщеплением кристаллов. Расщепление чрезвычайно распространено. Оно приводит к образованию макроблочных кристаллов (рис. 1-34), многоглавых и сноповидных кристаллов и в конце концов к радиально-лучистым агрегатам — сферолитам (рис. 1-35).

|
Рис. 1-33. Первичный субиидивид на грани призмы КH2Р04. Ув. 100.
Сочетание скелетного роста с расщеплением приводит к возникновению дендритных образований (дендритов) — древовидных образований, в которых в отличие от скелетных кристаллов единая решетка по всему кристаллическому образованию не сохраняется.

|
Рис. 1-34. Сросток блочных кристаллов желтой кровяной соли.
Ув. 2. Блочность вы звана расщеплением.

Рис. 1-35. Сферолиты цитрата натрия. Ув. 1.00.
Расщепляться при росте могут кристаллы любого вещества. Однако растут самостоятельно только те из образовавшихся при пластической деформации блоков, размеры которых по крайней мере больше диаметра двумерного критического зародыша. Чем вышe пересыщение, тем меньшие по размеру блоки смогут разрастаться, тем больше, следовательно, вероятность расщепления. При этом имеет значение не общее пересыщение в объеме раствора, а пересыщение непосредственно у растущей грани. Именно поэтому легче расщепляются кристаллы веществ, растущих в кинетической области.
Внутренние напряжения снимаются не только путем образования и перемещения дислокаций, не только при расщеплении, но и посредством механического двойникования при росте (§ 1.1), например ВаСl2 • 2Н20. Наблюдается также своеобразное сочетание двойникования и расщепления: двойниковое расщепление, т. е. такое расщепление монокристалла, при котором образуются сдвойникованные субиндивиды. Повышенная скорость роста сдвойникованных субиндивидов по сравнению с обычными приводит к тому, что последние подавляются и образуется сферолит, который называется двойниковым. Обычное и двойниковое расщепление проявляются одновременно в одном кристалле, обладают сходными закономерностями в своем развитии.
К двойникам, связь которых с автодеформацией не является очевидной, относят собственно двойники роста и их разновидность — двойники зарождения. К последним причисляют кристаллы, сдвойникованные уже к тому моменту, когда они становятся различимыми в оптический микроскоп.
При ростовом двойниковании в поверхностном слое растущего монокристалла происходит зарождение (разрастание) субиндивидов («сателлитов») в двойниковом положении относительно подложки.
Такой процесс напоминает начальный этап расщепления, но с двойниковой ориентировкой субиндивида. Типичным примером является кварц, для которого установлено, что образование ростовых двойниковых сателлитов (так называемых дофинейских и бразильских типов двойникования) вызывается захватом механических примесей [Карякина Т. А., 1974]. На примере гипса и ВаС1 • 2Н20 показано, что для одного и того же вещества наблюдается сходное влияние пересыщения и примесей на двойникование и расщепление, а также на образование механических двойников и двойников зарождения. Поэтому возникновение ростовых двойников — во многих случаях также один из способов снятия внутренних напряжений при росте, и мы можем причислить их к автодеформационным.
Ряд данных указывает на то, что политипия и образование синтаксических срастаний разных политипов (§ 1.1) также связаны с напряжениями, возникающими в кристалле при неоднородном захвате примесей.
Если материал непластичен, то напряжения разрешаются трещинами, обычно закономерно ориентированными. Иногда эти трещины поражают пирамиду роста лишь одной кристаллографической формы. Такие случаи отмечались при выращивании сегнетовой соли с примесью иона олова [Штернберг А. А., 1962], MgS04 • 7Н20. В некоторых случаях примеси приводят к «охрупчиванию» кристаллов, и макродефекты пластического типа (двойникование, расщепление) сменяются при введении таких примесей трещиноватостью.
Тот или иной тип деформации кристалла при росте определяется прежде всего механическими свойствами этого кристалла. Поэтому один и тот же материал в зависимости от температуры роста, характера захваченных примесей, распределения напряжений может проявлять и хрупкие, и пластические свойства. Оба типа деформаций могут осуществляться в непосредственной близости в объеме кристалла. Так, расщепление обычно сопровождается последующим растрескиванием кристалла. И наоборот, ростовая трещиноватость может приводить к расщеплению.
ГЛАВА
Дата добавления: 2016-09-20; просмотров: 1041;
