Примеры составления условий задач и их решения. Вычислить молярность и нормальность 40 %-го раствора фосфорной кислоты, плотность которого 1,25 г/см3
Задача 554
Вычислить молярность и нормальность 40 %-го раствора фосфорной кислоты, плотность которого 1,25 г/см3. Объем раствора 1л.
Решение:
Для расчета молярности и нормальности раствора найдем массу фосфорной кислоты в 1 л (1000 мл) 40 %-го раствора:
w = m1 · 100/V ∙ r; 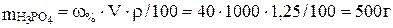 . Молярная масса Н3РO4 равна 98 г/моль, следовательно,
. Молярная масса Н3РO4 равна 98 г/моль, следовательно, 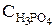 = 500/98 = 5,1 моль/л.
= 500/98 = 5,1 моль/л.
Молярная масса эквивалента Н3РO4 равна 98/3 = 32,7 г/моль.
Тогда СН = 500/32,7 = 1,53 моль/л.
Задача 578
Вычислить массовую долю КОН в 2н. растворе, плотность которого 1,08 г/см3.
Решение:
Поскольку нормальность рассчитывается на 1 л раствора, найдем массу растворенного вещества в 1 л:
СН= m1/Э∙V;
ЭKOH = 56 г/моль;
mКОН=2∙56∙1=112 г.
Теперь вычислим массовую доли КОН в растворе, содержащем 112г гидроксида калия:
w= m1∙100/V∙r=112∙100/1000∙1,08=10,4 %.
Задача 596
Какой объем 30%-го раствора азотной кислоты, плотность которого 1,18 г/см3, необходимо взять для приготовления 0,5 л 1,0 н. раствора?
Решение:
Сначала найдем массу азотной кислоты, необходимую для приготовления 0,5 л 1,0 н. раствора:
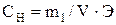 ;
; 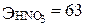 г/моль;
г/моль;
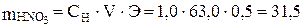 г.
г.
Вычислим, в каком объеме 30 %-го раствора содержится 31,5 г азотной кислоты:
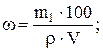
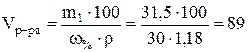 мл.
мл.
В задачах 541–568 определить молярность и нормальность следующих растворов. Объем раствора 1 л
| № задачи | Вещество | Массовая доля в растворе, % | Плотность раствора, г/см3 | № задачи | Вещество | Массовая доля в растворе, % | Плотность раствора, г/см3 |
| HNO3 HNO3 H2SO4 H2SO4 H2SO4 HCl HCl H3PO4 H3PO4 H3PO4 HClO4 NaCl NH4Cl H3PO4 | 20,0 30,0 32,0 54,0 92,0 15,0 40,0 4,0 44,0 50,0 16,0 12,0 40,0 | 1,115 1,180 1,235 1,435 1,824 1,073 1,198 1,020 1,285 1,335 1,100 1,086 1,028 1,250 | HClO4 Na2CO3 CH3COOH CH3COOH KOH KOH NaOH NaOH NaOH NH3 Na2CO3 NaCl CuSO4 HNO3 | 63,0 6,0 98,0 34,0 33,0 52,0 34,0 40,0 50,0 30,0 16,0 20,0 | 1,580 1,060 1,055 1,043 1,320 1,535 1,370 1,430 1,525 0,892 1,170 1,148 1,155 1,056 |
В задачах 569–594 определить массовую долю вещества в процентах. Объем раствора 1 л
| № задачи | Вещество | Концентрация раствора | Плотность раствора, г/см3 |
| H2SO4 HCl H3PO4 H3PO4 HClO4 HClO4 CH3COOH CH3COOH KOH KOH KOH NaOH NaOH NH3 Na2CO3 HNO3 AgNO3 Al2(SO4)3 BaCl2 CaCl2 CuCl2 CuSO4 FeCl3 K2CO3 KCl Na2CO3 | 13,0 М 9,5 М 9,0 н 8,0 М 4,0 н 11,5 М 6,3 М 17,5 М 3,7 н 2,0 н 6,0 М 0,15 М 2,8 М 1,1 М 0,30 М 9,0 н 1,40 М 0,55 М 2,30 н 1,19 М 2,0 н 0,85 М 1,90 М 6,0 М 2,7 н 0,8 М | 1,680 1,150 1,150 1,390 1,230 1,665 1,045 1,050 1,165 1,080 1,255 1,005 1,110 0,990 1,030 1,275 1,194 1,176 1,203 1,101 1,116 1,131 1,233 1,567 1,118 1,080 |
В задачах 595–619 определить объем концентрированного раствора, необходимый для приготовления определенного объема разбавленного раствора заданной концентрации
| № задачи | Исходные растворы | Приготовляемые растворы | |||
| Вещество | Концентрация | Плотность г/см3 | Объем, л | Концентрация | |
| KOH | 30,0 | 1,288 | 0,10 | 0,5 н | |
| HNO3 | 30,0 | 1,180 | 0,50 | 1,0 н | |
| H3PO3 | 40,0 | 1,254 | 0,1 | 0,1 н | |
| HCl | 10,0 | 1,047 | 2,0 | 0,2 м | |
| H2SO4 | 70,0 | 1,611 | 0,25 | 0,5 н | |
| H2SO4 | 96,0 | 1,840 | 0,50 | 0,5 м | |
| NaOH | 15,0 | 1,164 | 3,0 | 0,1 н | |
| AgNO3 | 18,0 | 1,171 | 0,10 | 2,0 н | |
| AlCl3 | 10,0 | 1,090 | 0,20 | 0,1 м | |
| BaCl2 | 16,0 | 1,156 | 0,25 | 0,01 н | |
| CaCl2 | 30,0 | 1,282 | 0,50 | 0,5 м | |
| CuSO4 | 14,0 | 1,155 | 1,0 | 0,5 н | |
| FeCl3 | 35,0 | 1,353 | 2,0 | 1 н | |
| K2CO3 | 28,0 | 1,276 | 3,0 | 0,1 м | |
| KCl | 24,0 | 1,162 | 0,10 | 0,5 м | |
| KNO3 | 20,0 | 1,133 | 0,20 | 3 н | |
| MgSO4 | 26,0 | 1,296 | 0,50 | 0,02 м | |
| NH4Cl | 22,0 | 1,062 | 1,0 | 0,01 н | |
| NaCl | 8,0 | 1,056 | 0,25 | 0,2 м | |
| Na2CO3 | 8,8 | 1,090 | 1,0 | 0,1 н | |
| Na2CO3 | 16,0 | 1,170 | 2,0 | 0,03 м | |
| NaNO3 | 45,0 | 1,388 | 5,0 | 0,02 н | |
| Na2SO4 | 12,0 | 1,111 | 0,1 | 0,5 н | |
| ZnCl2 | 25,0 | 1,238 | 2,0 | 0,2 м | |
| CH3COOH | 70,0 | 1,069 | 5,0 | 0,2 м |
При выполнении заданий рекомендуется использовать методические указания [7].
Дата добавления: 2016-08-07; просмотров: 7920;
