Гальванические элементы
Гальваническими элементами называются устройства, с помощью которых химическая энергия окислительно-восстановительных процессов может быть преобразована в электрическую. В основе работы гальванических элементов лежат явления, происходящие на границе между металлом и раствором электролита и сопровождающиеся возникновением на ней разности или скачка потенциалов.
Разности или скачки потенциалов на границе металл-раствор зависят от активности катионов металла в растворе или, другими словами, каждой данной активности катионов металла в растворе соответствует определенное значение равновесного скачка потенциалов. Они называются электродными потенциалами, а их значения определяются относительно стандартного водородного электрода, принятого в качестве эталона, потенциал которого, называемый стандартным или нормальным, условно принимается равным нулю.
Всякий гальванический элемент состоит из двух электродов – металлов, погруженных в растворы электролитов; последние сообщаются друг с другом – обычно через пористую перегородку. Электрод, на котором в ходе реакции происходит процесс окисления, называется анодом; электрод, на котором осуществляется восстановление, – катодом.
При схематическом изображении гальванического элемента граница раздела между металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов – двойной вертикальной чертой: Zn|Zn(NO3)2 ||AgNO3|Ag.
Максимальное напряжение гальванического элемента, отвечающее обратимому протеканию происходящей в нем реакции, называется электродвижущей силой Е (э.д.с.) элемента.
Если реакция осуществляется в стандартных условиях, т.е., если все вещества, участвующие в реакции, находятся в своих стандартных состояниях, то наблюдаемая при этом э.д.с. называется стандартной электродвижущей силой Ео данного элемента.
Э.д.с. гальванического элемента может быть представлена как разность двух электродных потенциалов φ, каждый из которых отвечает полуреакции, протекающей на одном из электродов:
Е = φAg – φZn .
Здесь φAg и φZn – потенциалы, отвечающие электродным процессам, происходящим соответственно на серебряном и цинковом электродах.
Примеры составления условий задач и их решения
Задача 399
Составить схему, написать уравнения электродных процессов и рассчитать э.д.с. элемента, состоящего из цинковой и никелевой пластин, опущенных в растворы сернокислых солей с концентрацией 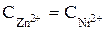 = 0,01 моль/л.
= 0,01 моль/л.
Решение:
В ряду напряжений Zn стоит левее Ni, поэтому в гальваническом элементе отрицательным (анодом) будет цинковый электрод, а положительным (катодом) - никелевый.
Схема гальванического элемента
(-) Zn½ZnSO4½½NiSO4½Ni (+).
При работе элемента протекают реакции:
на аноде Zn ® Zn2+ + 2e,
на катоде Ni2+ + 2e ® Ni.
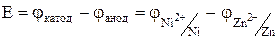
Электродные потенциалы необходимо вычислить по уравнению Нернста:
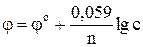 .
.
 .
.
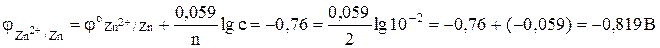 .
.
Отсюда Е = -0,309 - (-0,819) = 0,51 В.
С учетом того, что число электронов, переносимых во время электрохимической реакции металлами, одинаково и концентрации растворов равны, уравнение упрощается и принимает вид
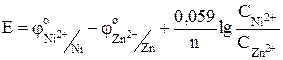 ;
; 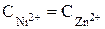 ;
;
 .
.
Гальванический элемент может быть составлен не только из различных, но и из одинаковых электродов, погруженных в растворы одного и того же электролита, различающиеся только концентрацией (концентрационные гальванические элементы). Э.д.с. такого элемента также равна разности потенциалов составляющих его электродов.
Электрод, погруженный в более концентрированный раствор, положителен по отношению к другому, который погружен в более разбавленный раствор.
Задача 406
Вычислить электродвижущую силу концентрационного элемента:
Cu½CuCrO4 (C1=0,01 моль/л) ½½ CuCrO4 (C2=0,1 моль/л)½Cu.
Решение:
Рассчитаем э.д.с. по уравнению
 .
.
Элемент будет действовать до тех пор, пока не выравнится концентрация ионов у обоих электродов.
Задача 423
Составить схему гальванического элемента, в котором протекает токообразующая реакция:
Cd + CuSO4 (C=1 моль/л) ® CdSO4 (C=1 моль/л) + Cu.
Вычислить э.д.с. элемента и энергию Гиббса DG.
Решение:
По ряду напряжения находим:
 ;
;  .
.
Реакция окисления должна протекать на аноде, а реакция восстановления – на катоде, значит, элемент запишем в виде
(-) Cd½CdSO4½½CuSO4½Cu (+).
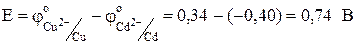 .
.
Изменение энергии Гиббса вычислим по уравнению DG = nFE0, где n -число электронов, принимающих участие в электрохимической реакции,
F – число Фарадея (96 500 Кл или 96 500 Дж/В×моль).
DG = -2×96500×0,74 = -142,820 кДж/моль.
Таким образом, для любого электрохимического элемента, работающего самопроизвольно, Е должна быть положительной, а DG , соответственно, отрицательной.
Задача 449
Исходя из величин стандартных электродных потенциалов рассчитать константу равновесия реакции, протекающей в гальваническом элементе:
Cu + 2AgNO3 ® Cu(NO3)2 + 2Ag.
Решение:
По ряду напряжений находим, 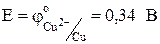 ,а
,а  . Отсюда следует, что медный электрод будет отрицательным, т.е. анодом:
. Отсюда следует, что медный электрод будет отрицательным, т.е. анодом:
(-) Cu½Cu2+ ½½Ag+½Ag (+).

Между константой равновесия реакции, протекающей в гальваническом элементе, и э.д.с. элемента существует зависимость
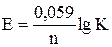 , откуда
, откуда 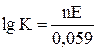 .
.
Вычислим константу равновесия реакции:
 K = 3,8∙1015.
K = 3,8∙1015.
Сопоставляя электродные потенциалы, можно заранее определить направление, в котором будет протекать окислительно-восстановительная реакция. Поскольку
 ,
,
то окислителем будет служить ион серебра, а восстановителем – медь: рассматриваемая реакция будет протекать слева направо. По величине константы равновесия (К=3,8 ×1015) судим о сдвиге равновесия реакции в сторону продуктов реакции. Число 1015 означает, что равновесие в данной системе наступит тогда, когда произведение концентрации ионов исходных продуктов будет в 1015 раз меньше произведения концентраций ионов конечных продуктов.
Задача 420
Определить э.д.с. элемента, у которого электродами являются две платиновые пластинки, опущенные в растворы SnCl2 и FeCl3. Составить схему гальванического элемента.
Решение:
В этом элементе по проводнику, соединяющему электроды, будет идти электрический ток в результате окислительно-восстановительной реакции:
SnCl2 + 2FeCl3 ® SnCl4 + 2FeCl2.
В подобных гальванических элементах электроды (Рt) не участвуют во взаимодействии, а являются лишь переносчиками электронов. Схему элемента для приведенной выше реакции можно представить следующим образом:
(-) Pt, Sn2+ ½Sn4+ ½½Fe3+ ½Fe2+ , Pt(+).
На аноде Sn2+ -2e ® Sn4+ j01= + 0,15В.
На катоде Fe3+ +e ® Fe2+ j02= + 0,771 В.
Sn2+ + 2Fe3+ ® Sn4+ + 2Fe2+.
Исходные и полученные в результате реакции ионы олова образуют окислительно-восстановительную пару Sn2+/Sn4+, которая является одним из полуэлементов. Вторым полуэлементом является окислительно-восстановительная пара Fe3+/Fe2+.
Разность потенциалов на границе между инертным электродом и раствором, содержащим окисленную и восстановленную формы вещества, называют окислительно-восстановительным потенциалом:
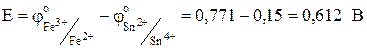 .
.
При выполнений заданий рекомендуется использовать методические указания [5].
Стандартные значения электродных потенциалов найти в табл. 4 приложения.
В задачах 392–420 определить электродвижущую силу элементов, написать уравнения реакций, за счет которых возникает разность потенциалов. Составить схемы элементов
| № задачи | 1-й полуэлемент | 2-й полуэлемент |
| Mg; MgSO4 (C1=0,1 моль/л) | Fe; FeSO4 (C2=0,01 моль/л) | |
| Cd; CdSO4 (C1=0,01 моль/л) | Cd; CdSO4 (C2=0,1 моль/л) | |
| Pt, H2; H2SO4 (C1=1 моль/л) | Ag; AgNO3 (C2=0,1 моль/л) | |
| Al; AlCl3 (C1=0,1 моль/л) | Pt, H2; HCl (C2=1 моль/л) | |
| Pb; Pb(NO3)2 (C1=0,01 моль/л) | Cu; Cu(NO3)2 (C2=1 моль/л) | |
| Fe; Fe(NO3)2 (C1=1 моль/л) | Pb; Pb(NO3)2 (C2=1 моль/л) | |
| Ag; AgNO3 (C1=0,1 моль/л) | Ag; AgNO3 (C2=1 моль/л) | |
| Zn; ZnSO4 (C1=0,01 моль/л) | Ni; NiSO4 (C2=0,01 моль/л) | |
| Ni; NiSO4 (C1=0,001 моль/л) | Cu; CuSO4 (C2=0,01 моль/л) | |
| Cd; CdCl2 (C1=1 моль/л) | Sn; SnCl2 (C2=0,01 моль/л) | |
| Zn; ZnSO4 (C1=1 моль/л) | Pt, H2; H2SO4 (C2=1 моль/л) | |
| Fe; FeCl2 (C1=0,1 моль/л) | Ag; AgCl (C2=0,01 моль/л) | |
| Fe; FeCl2 (C1=1 моль/л) | Sn; SnCl2 (C2=1 моль/л) | |
| Mg; Mg(NO3)2 (C1=0,01 моль/л) | Pb; Pb(NO3)2 (C2=0,01 моль/л) | |
| Cu; CuCrO4 (C1=0,01 моль/л) | Cu; CuCrO4 (C2=0,1 моль/л) | |
| Cd; CdCl2 (C1=0,1 моль/л) | Pb; PbCl2 (C2=0,1 моль/л) | |
| Cu; CuCl2 (C1=0,1 моль/л) | Pt, Cl2; 2Cl– (C2=1 моль/л) | |
| Cr; CrSO4 (C1=0,001 моль/л) | Ni; NiSO4 (C2=0,01 моль/л) | |
| Pt, H2; H2SO4 (C1=0,1 моль/л) | Ag; AgI (C2=0,01 моль/л) | |
| Zn; ZnCl2 (C1=1 моль/л) | Cr; CrCl3 (C2=0,1 моль/л) | |
| Pt, H2; H2SO4 (C1=0,1 моль/л) | Pb; PbSO4 (C2=1 моль/л) | |
| Fe; FeBr2 (C1=0,1 моль/л) | Cu; CuBr2 (C2=0,1 моль/л) | |
| Zn; ZnSO4 (C1=0,1 моль/л) | Cu; CuSO4 (C2=0,001 моль/л) | |
| Pt, H2; HCl (C1=1 моль/л) | Fe; FeCl2 (C2=0,1 моль/л) | |
| Sn; SnSO4 (C1=1 моль/л) | Pt, H2; H2SO4 (C2=1 моль/л) | |
| Fe; FeCl2 (C1=0,1 моль/л) | Ag; AgCl (C2=0,01 моль/л) | |
| Cd; CdI2 (C1=1 моль/л) | Ag; AgI (C2=1 моль/л) | |
| Cd; Cd(NO3)2 (C1=0,1 моль/л) | Cu; Cu(NO3)2 (C2=0,1 моль/л) | |
| Pt, Sn2+ ; Sn4+ (C1=1 моль/л) | Fe3+ ; Fe2+ (C2=1 моль/л) |
В задачах 421–445 составить схемы гальванических элементов, в которых протекают приведенные ниже токообразующие реакции. Вычислить э.д.с. элементов. Чему равно DG?
| № задачи | Токообразующая реакция |
| H2 + Cu2+ (C=0,1 моль/л) ® 2H+ (C=1моль/л) + Cu | |
| 2Al + 3Fe2+ (C=1моль/л) ® 2Al3+(C=0,01моль/л) + 3Fe | |
| Cd + CuSO4 (C=1моль/л) ® CdSO4 (C=1моль/л) + Cu | |
| Zn + 2H+ (C=1моль/л) ® Zn2+ (C=0,1 моль/л) + H2 | |
| Mg + H2SO4 (C=1моль/л) ® MgSO4 (C=1моль/л) + H2 | |
| Cu + 2AgNO3 (C=0,1 моль/л) ® Cu(NO3)2 (C=0,1 моль/л) + 2 Ag | |
| Mg + Fe2+ (C=1моль/л) ® Mg2+(C=0,01моль/л) + Fe | |
| Fe + Cu2+(C=0,01моль/л) ® Fe2+ (C=1моль/л) + Cu | |
| Ni + CuSO4 (C=1моль/л) ® NiSO4 (C=1моль/л) + Cu | |
| Cd + SnCl2 (C=0,1 моль/л) ® CdCl2 (C=0,01моль/л) + Sn | |
| Zn + Cu2+ (C=1моль/л) ® Zn2+ (C=1моль/л) + Cu | |
| Cu + Cl2 (C=1моль/л) ® Cu2+ (C=1моль/л) + 2Cl- | |
| Hg2+ (C=0,1 моль/л) + 2Ag ® Hg + 2Ag+(C=1×10-4моль/л) | |
| 3Zn + 2 Cr3+(C=1×10-3моль/л) ® 3Zn2+(C=1×10-4моль/л) + 2Cr | |
| Sr + H2SO4 (C=1моль/л) ® SrSO4 (C=1моль/л) + H2 | |
| Be + Cо2+ (C=0,1 моль/л) ® Be2+ (C=0,01моль/л) + Cо | |
| 2Fe(NO3)2 + Hg2(NO3)2 (C=1моль/л)® 2Fe(NO3)3(C=1моль/л)+2Hg | |
| Cu + 2AgCl(C=0,01моль/л) ® CuCl2 (C=0,001моль/л) + 2Ag | |
| H2 + 2Ag+ (C=1моль/л) ® 2H+ (C=0,1 моль/л) + 2Ag | |
| Cd + PbCl2 (C=0,01моль/л) ® CdCl2(C=0,01моль/л) + Pb | |
| Pb + 2AgNO3 (C=0,1 моль/л) ® Pb(NO3)2 (C=0,01моль/л) + 2Ag | |
| Zn +Hg2Cl2 (C=1моль/л) ® ZnCl2 (C=1моль/л) + 2Hg | |
| Cd + 2AgCl (C=0,1 моль/л) ® CdCl2 (C=0,01моль/л) + 2Ag | |
| Sc + Bi3+ (C=0,1 моль/л) ® Sc3+ (C=0,1 моль/л) + Bi | |
| Sn + CuCl2 (C=1моль/л) ® SnCl2 (C=1моль/л) + Cu |
В задачах 446–471 вычислить константы равновесия окислительно-восстановительных реакций, протекающих в гальванических элементах
| № задачи | Уравнение реакции |
| SnCl2 + 2FeCl3 ® SnCl4 + 2FeCl2 | |
| Zn + CdSO4 ® ZnSO4 + Cu | |
| Pb + Cu(NO3)2 ® Pb(NO3)2 + Cu | |
| Cu +2AgNO3 ® Cu(NO3)2 + 2Ag | |
| Mg + H2SO4 ® MgSO4 + H2 | |
| Zn + CuSO4 ® ZnSO4 + Cu | |
| Al + CrCl3® AlCl3 + Cr | |
| 5FeCl2 + KMnO4 + 8HCl ® MnCl2 + KCl + 5FeCl3 + 4H2O | |
| H3PO3 + 2AgNO3 + H2O ® H3PO4 + 2Ag + 2HNO3 | |
| 2KBr + PbO2 + 4HNO3 ® Pb(NO3)2 + Br2 + 2KNO3 + 2H2O | |
| Fe + CuSO4 ® FeSO4 + Cu | |
| Pb + Hg2Cl2 ® PbCl2 + 2Hg | |
| Cd + CuSO4 ® CdSO4 + Cu | |
| 4FeCl2 + O2 + 4HCl ® 4FeCl3 + 2H2O | |
| Mn + NiCl2 ® MnCl2 + Ni | |
| 2Al + 3 Pb(NO3)2 ® 2Al(NO3)3 + 3Pb | |
| Sn + HgSO4 ® SnSO4 + Hg | |
| FeBr2 + CoBr3 ® FeBr3 + Co | |
| Zn + Pb(NO3)2 ® Zn(NO3)2 + Pb | |
| 2FeSO4 +Cl2 + Na2SO4 ® 2NaCl + Fe2(SO4)3 | |
| Zn + Hg2Cl2 ® ZnCl2 + 2Hg | |
| Cu + 2AgCl ® CuCl2 + 2Ag | |
| Cd + SnCl2 ® CdCl2 + Sn | |
| Fe + Pb(NO3)2 ® Fe(NO3)2 + Pb | |
| Ni + CuSO4 ® NiSO4 + Cu | |
| Ca + H2SO4 ® CaSO4 + H2 |
Электролиз
Электролиз представляет собой процесс, в котором окислительно-восстановительные реакции происходят под действием постоянного электрического тока. Химические реакции при электролизе обратны реакциям в гальванических элементах.
При электролизе растворов солей необходимо помнить правила:
1. Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до AI3+ включительно), не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды:
2H2O +2e ® H2 + 2OH–.
2. Катионы металлов, имеющих стандартный электродный потенциал меньший, чем у водорода, но больший, чем у алюминия (от AI до H2) при электролизе восстанавливаются одновременно с молекулами воды. Причиной этого явления служит более высокая концентрация катионов металла в растворах по сравнению с ионами водорода ( 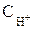 = 10–7моль/л), а также явление перенапряжения.
= 10–7моль/л), а также явление перенапряжения.
3. Катионы металлов, имеющих стандартный электродный потенциал больший, чем у водорода (от Sb3+ + до Аu+), при электролизе практически полностью восстанавливаются на катоде.
4. На нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды. При этом анионы бескислородных кислот ( S2-, I- ,Вг-, С1-) при их достаточной концентрации легко окисляются. Если же раствор содержит анионы кислородных кислот (например, SO42–, NO3–, СО3 2–, PO43–), то на аноде окисляются не эти ионы, а молекулы воды:
2H2O + 4e ® O2 + 4H+.
5. Растворимый анод сам подвергается окислению (растворению), т.е. поcылает электроны во внешнюю цепь. При отдаче электронов смещается равновесие между электродом и раствором:
Me ↔ Men+ + ne .
металл уходят уходят во
анода в раствор внешнюю цепь
Дата добавления: 2016-08-07; просмотров: 3720;
